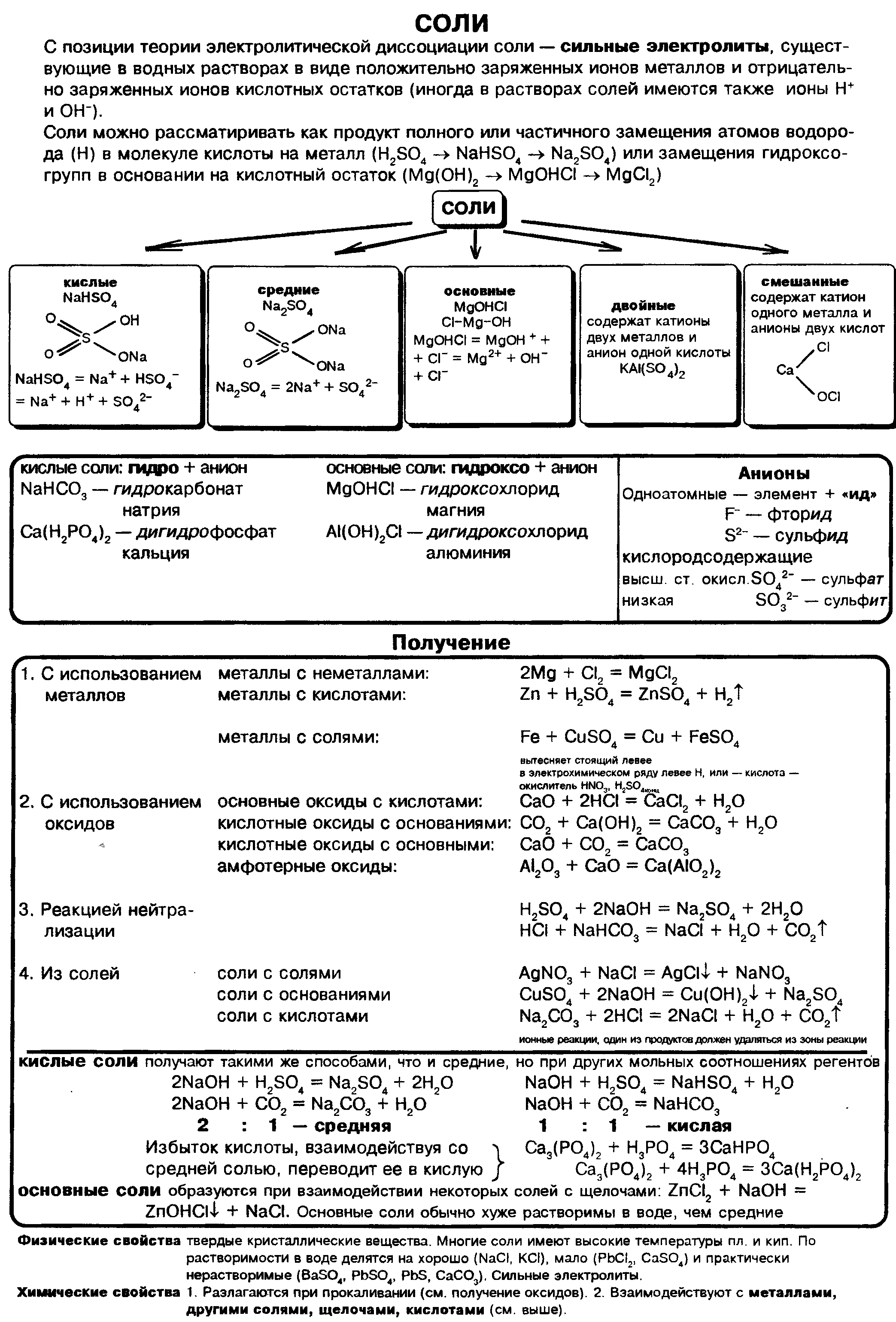
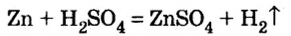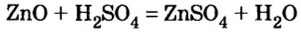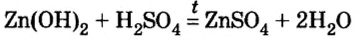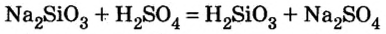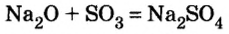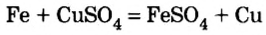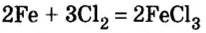Формула соли поваренной. Химическая формула: поваренная соль. Свойства поваренной соли
Поваренная соль — это хлорид натрия, применяемый в качестве добавки к пище, консерванта продуктов питания. Используется также в химической промышленности, медицине. Служит важнейшим сырьем для получения едкого натра, соляной кислоты, соды и других веществ. Формула соли поваренной — NaCl.
Образование ионной связи между натрием и хлором
Химический состав хлорида натрия отражает условная формула NaCl, которая дает представление о равном количестве атомов натрия и хлора. Но вещество образовано не двухатомными молекулами, а состоит из кристаллов. При взаимодействии щелочного металла с сильным неметаллом каждый атом натрия отдает валентный электрон более электроотрицательному хлору. Возникают катионы натрия Na + и анионы кислотного остатка соляной кислоты Cl – . Разноименно заряженные частицы притягиваются, образуя вещество с ионной кристаллической решеткой. Маленькие катионы натрия расположены между крупными анионами хлора. Число положительных частиц в составе хлорида натрия равно количеству отрицательных, вещество в целом является нейтральным.
Химическая формула. Поваренная соль и галит
Соли — это сложные вещества ионного строения, названия которых начинаются с наименования кислотного остатка. Формула соли поваренной — NaCl. Геологи минерал такого состава называют «галит», а осадочную породу — «каменная соль». Устаревшей химический термин, который часто употребляется на производстве, — «хлористый натрий». Это вещество известно людям с глубокой древности, когда-то его считали «белым золотом». Современные ученики школ и студенты при чтении уравнений реакций с участием хлорида натрия называют химические знаки («натрий хлор»).
Проведем несложные расчеты по формуле вещества:
1) Mr (NaCl) = Ar (Na) + Ar (Cl) = 22,99 + 35,45 = 58,44.
Относительная молекулярная масса составляет 58,44 (в а.е.м.).
2) Численно равна молекулярному весу молярная масса, но эта величина имеет единицы измерения г/моль: М (NaCl) = 58,44 г/моль.
3) Образец соли массой 100 г содержит 60,663 г атомов хлора и 39,337 г натрия.
Физические свойства поваренной соли
Хрупкие кристаллы галита — бесцветные или белые. В природе также встречаются месторождения каменной соли, окрашенной в серый, желтый либо голубой цвет. Иногда минеральное вещество обладает красным оттенком, что обусловлено видами и количеством примесей. Твердость галита по шкале Мооса составляет всего 2-2,5, стекло оставляет на его поверхности черту.
Другие физические параметры хлорида натрия:
- запах — отсутствует;
- вкус — соленый;
- плотность — 2,165 г/ см3 (20 °C);
- температура плавления — 801 °C;
- точка кипения — 1413 °C;
- растворимость в воде — 359 г/л (25 °C);
Получение хлорида натрия в лаборатории
При взаимодействии металлического натрия с газообразным хлором в пробирке образуется вещество белого цвета — хлорид натрия NaCl (формула поваренной соли).
Химия дает представление о различных способах получения одного и того же соединения. Вот некоторые примеры:
Окислительно-восстановительная реакция между металлом и кислотой:
Действие кислоты на оксид металла: Na2O + 2HCl (водн.) = 2NaCl + H2O
Вытеснение слабой кислоты из раствора ее соли более сильной:
Для применения в промышленных масштабах все эти методы слишком дорогие и сложные.
Производство поваренной соли
Еще на заре цивилизации люди знали, что после засолки мясо и рыба сохраняются дольше. Прозрачные, правильной формы кристаллы галита использовались в некоторых древних странах вместо денег и были на вес золота. Поиск и разработка месторождений галита позволили удовлетворить растущие потребности населения и промышленности. Важнейшие природные источники поваренной соли:
- залежи минерала галита в разных странах;
- вода морей, океанов и соленых озер;
- прослойки и корки каменной соли на берегах соленых водоемов;
- кристаллы галита на стенках вулканических кратеров;
- солончаки.
В промышленности используются четыре основных способа получения поваренной соли:
- выщелачивание галита из подземного слоя, испарение полученного рассола;
- добыча в соляных шахтах;
- выпаривание морской воды или рассола соленых озер (77% от массы сухого остатка приходится на хлорид натрия);
- использование побочного продукта опреснения соленых вод.
Химические свойства хлорида натрия
Сферы применения каменной соли
Хлорид натрия снижает температуру плавления льда, поэтому зимой на дорогах и тротуарах используется смесь соли с песком. Она впитывает в себя большое количество примесей, при таянии загрязняет реки и ручьи. Дорожная соль также ускоряет процесс коррозии автомобильных кузовов, повреждает деревья, посаженные рядом с дорогами. В химической промышленности хлорид натрия используется как сырье для получения большой группы химических веществ:
- соляной кислоты;
- металлического натрия;
- газообразного хлора;
- каустической соды и других соединений.
Кроме того, поваренная соль применяется в производстве мыла, красителей. Как пищевой антисептик используется при консервировании, засолке грибов, рыбы и овощей. Для борьбы с нарушениями работы щитовидной железы у населения формула соли поваренной обогащается за счет добавления безопасных соединений йода, например, KIO3, KI, NaI. Такие добавки поддерживают выработку гормона щитовидной железы, предотвращают заболевание эндемическим зобом.
Источник статьи: http://fb.ru/article/140084/formula-soli-povarennoy-himicheskaya-formula-povarennaya-sol-svoystva-povarennoy-soli
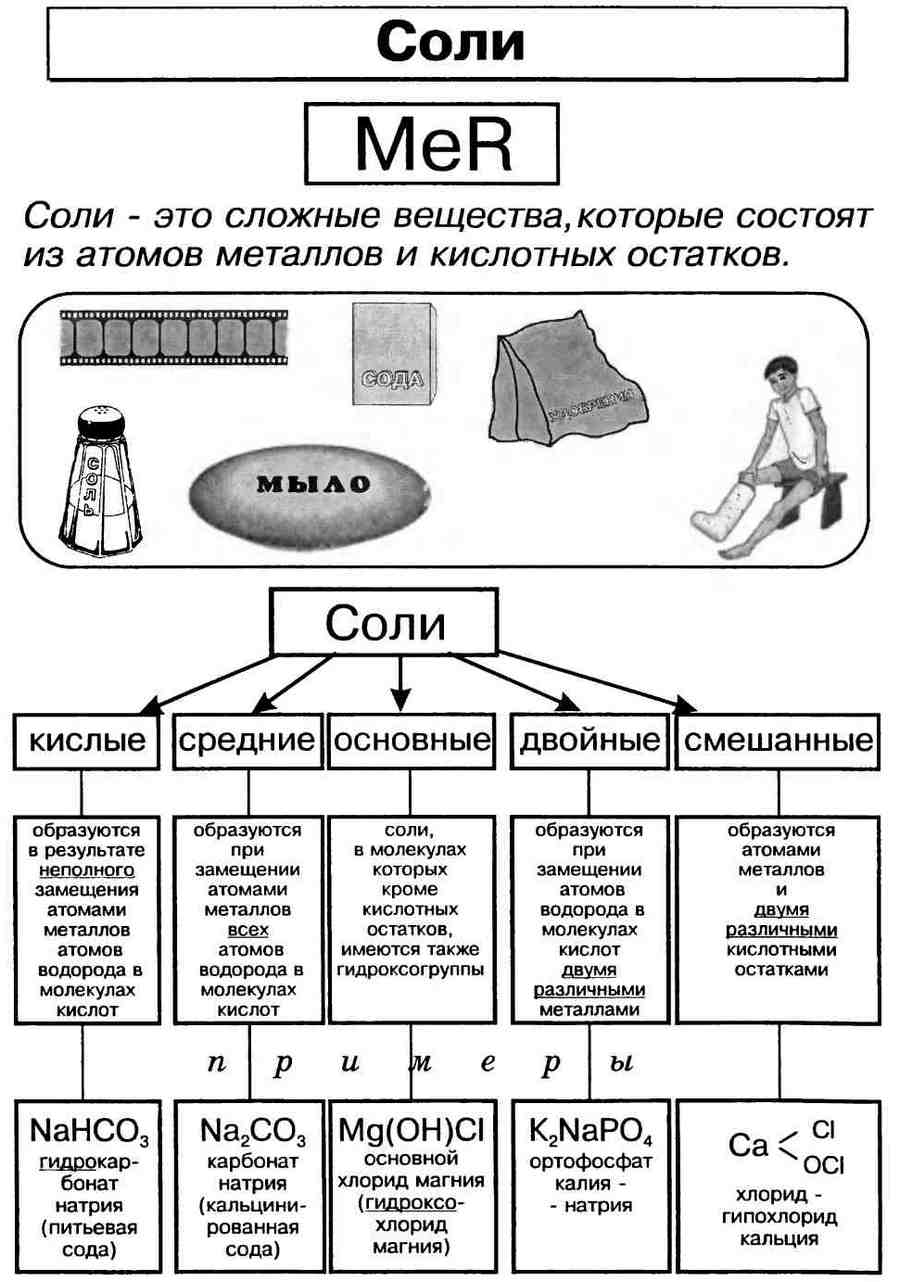
Соли в химии – общая характеристика, классификация и примеры соединений с названиями
Общие сведения
Все соли имеют сложный химический состав и в зависимости от него могут быть органическими или неорганическими. В теоретической химии существует несколько определений этой группы веществ:
- являющиеся результатом взаимодействия оснований и кислот;
- соединения, образованные одним или несколькими кислотными остатками и ионом металла;
- при электролитической диссоциации — состоящие из катионов и анионов.
Кроме металлов, к кислотным остаткам могут присоединяться ионы аммония (NH4)+, гидроксония (Н3О)+, фосфония (РН4)+ и некоторые другие. С физической точки зрения чаще всего соли — это твердые кристаллические вещества. Встречаются вещества разной окраски. Прозрачные единичные кристаллы в большом количестве имеют белый цвет, например, поваренная соль NaCl.
Их строение представляет собой кристаллическую решетку, в узлах которой находятся анионы, а катионы занимают пространство между узлами. Другое распространенное строение — анионные фрагменты из кислотных остатков, соединенные в бесконечную цепочку, в трехмерных полостях которых находятся катионы. Такую структуру имеют силикаты, что отражается и на их свойствах: высокая температура плавления и неспособность проводить электрический ток.
Кроме ионных, в молекулах солей встречаются и молекулярные ковалентные связи, и промежуточные между ковалентными и ионными. В особую группу солей выделяются так называемые ионные жидкости, температура плавления которых ниже 100 °C, отличающиеся повышенной вязкостью.
Для изучения химических и физических свойств этой группы соединений важным критерием служит их растворимость в воде: полностью, частично или нерастворимые.
Классификация и номенклатура
Основные классы этой группы веществ были описаны французским химиком и аптекарем Г. Руэлем еще в 1754 году, а по мере развития химии к ним добавились новые. Главный принцип классификации солей основан на том, что при взаимодействии металла и кислоты в ней происходит частичное или полное замещение атомов водорода.
Общие характеристики
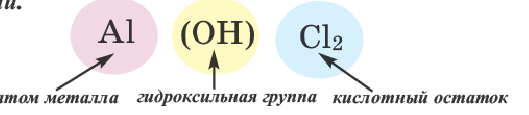
Формулы солей всегда образуются одним или несколькими металлами, кислотными остатками и гидроксильными группами. В зависимости от этого все солевые соединения делят на такие классы:
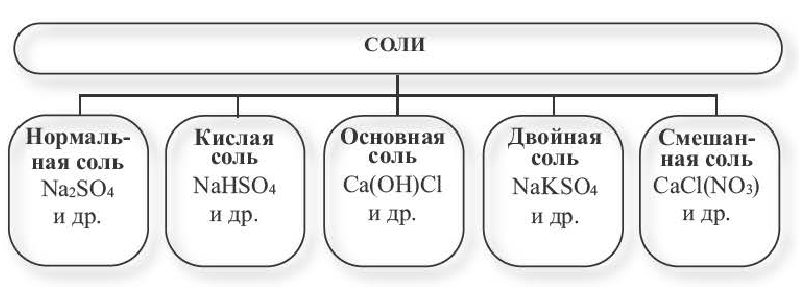
- Средние.
- Кислые.
- Основные.
- Двойные или смешанные.
- Комплексные.
- Кристаллогидраты.
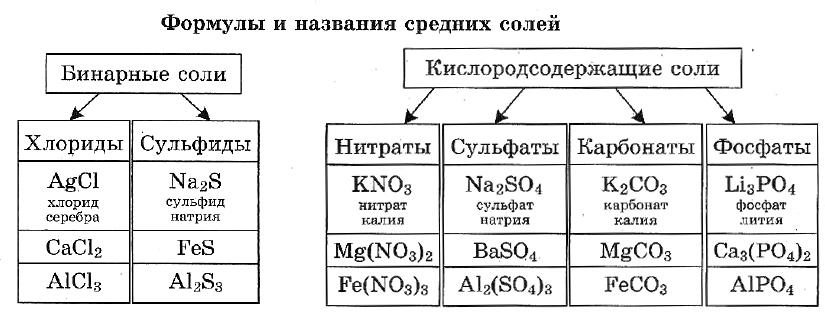
Средними считаются те, у которых все атомы водорода образующей кислоты заменены атомами металла. К такому типу соединений относятся и те, в которых водород замещается одновалентной группой аммония NH4. Согласно принятой номенклатуре, названия этих веществ образуются из латинского названия кислотного остатка и русского названия металла. Кислородосодержащие остатки оканчиваются на «ат», бескислородные — на «ид». Например:
- Na2CO3 — карбонат натрия.
- NaCl — хлорид натрия.
- KNO3 — нитрат калия.
Если одному химическому элементу соответствует не одна кислота, то может использоваться и окончание «ит». Это относится к таким кислотам, как серная H2SO4 (сульфаты) и сернистая H2SO3 (сульфиты).
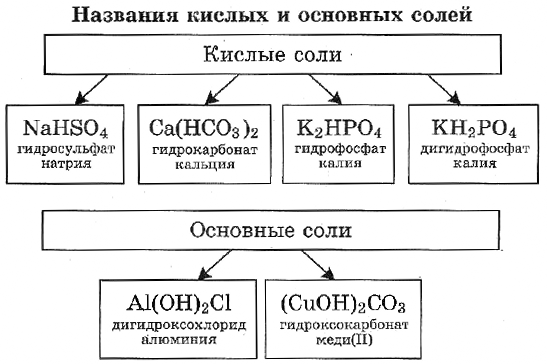
Кислые вещества образуются только от двух- или полиосновных кислот: серной, фосфорной, угольной. Они относятся к неустойчивым соединениям и при нагревании происходит их разложение на составляющие элементы. В названии таких веществ всегда используют приставку «гидро», а если незамещенных атомов водорода осталось два — приставку «ди»:
- NaHSO4 — гидросульфат натрия.
- CaHPO4 — гидрофостфат кальция.
- KH2PO4 — дигидрофосфат калия.
Образование основных солей происходит при частичном замещении гидроксильных групп кислотными остатками, причем валентность основного остатка всегда будет равна числу замещенных гидроксильных групп. Номенклатура названий таких химических соединений образуется в зависимости от количества гидроксогрупп приставками «гидроксо» и «дигидроксо»:
- Аl (OH)SO4 — гидроксосульфит алюминия.
- Cu (OH)Cl — гидроксохлорид меди.
- Fe (OH)2NO3 — дигидроксохлорид железа.
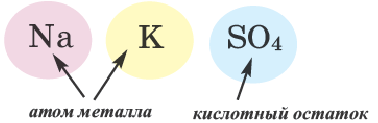
В двойных солях атомы водорода замещаются двумя разными металлами, соответственно и образовываться могут только от двух и более основных кислот: MgK (SO4)2, NaKCO3, KAl (SO4)2.
Комплексные соединения и кристаллогидраты
Этот класс химических соединений отличается большим разнообразием. В изучении комплексных солей (КС) большую роль сыграли швейцарский ученый А. Вернер и русский химик немецкого происхождения В. Освальд. КС состоят из комплексных частиц. Центральный элемент в комплексе называется комплексообразователем, а связанные с ним элементы — лигандами. Их число — это координационное число соединения. Лигандами могут быть как нейтральные молекулы, так и разнообразные ионы и катион водорода H+.
КС так и классифицируются на нейтральные, анионные и катионные. Разными лигандами образуются такие группы химических веществ:
- амиакаты, в которых с комплексообразователем связаны молекулы аммиака — [Co (NH3)6]Cl3;
- аквакомплексы, образованные лигандами воды — [Al (H2O)6]Cl3;
- ацидокомплексы, включающие кислотные остатки — K2[PtCl4].
Кристаллы, образующиеся в водном растворе при выпадении в осадок солей, называются кристаллогидратами. При этом между молекулами воды и солевыми ионами формируются прочные связи, образующие кристаллическую решетку. Химические формулы кристаллогидратов записывают в виде количественного соотношения соли и воды, разделенных точкой — Na2SO4⋅10H2O. В номенклатуре для обозначения количества воды употребляются греческие числа — ди, три, тетра, гекса и так далее, с которых и начинается название. Число выступает приставкой к слову «гидро», а затем следует стандартное название соли: CaSO4⋅2H2O — дигидрат сульфата кальция.
Исторические наименования
Названия химических веществ соответствуют международной системе правил, позволяющей давать им названия, по которым можно правильно составить их формулу. Многие соединения солевой группы давно и хорошо известны, и в процессе их использования химики много лет назад уже как-то называли их. Традиционные или тривиальные названия полезно знать любому человеку. Их список приведен в таблице:
| Соль | Номенклатурное название | Тривиальное название |
| CuSO4⋅5H2O | Пентагидрат сульфата меди | Медный купорос |
| CaCO3 | Карбонат кальция | Известняк |
| AgNO3 | Нитрат серебра | Ляпис |
| NaHCO3 | Гидрокарбонат натрия | Питьевая сода |
| K2СO3 | Карбонат калия | Поташ |
| HgCl2 | Хлорид ртути | Сулема |
| Na2SiO3 | Силикат натрия | Жидкое стекло |
Это далеко не полный перечь общеизвестных наименований. Какой-либо системе они не подчиняются, и тем, кто изучает химию, их надо просто запомнить.
Химические свойства
Соли как химические соединения проявляют разные свойства в зависимости от их структурного состава. В водных растворах могут диссоциировать на анион металла и катион кислотного остатка. Степень диссоциации зависит от того, какую способность растворяться имеют разные виды солей: растворимые диссоциируют полностью, нерастворимые — частично или не диссоциируют. Ход такой реакции зависит от вида соли: средние, двойные и комплексные распадаются на ионы одномоментно, а кислые и основные — ступенчато. Примеры:
- Хлорид натрия: NaCl ↔ (Na+) + (Cl-).
- Сульфат калия-натрия: КNaSO4 ↔ (К+) + (Na+) + (SO42-).
- Хлорид-бромид кальция: CaClBr ↔ (Ca2+) + (Cl -)+ (Br-).
- Гидросульфат калия: КHSO4 ↔ (К+) + (НSO4-), а затем (HSO4-) ↔ (H+) + (SO42-).
- Гидроксохлорид железа: FeOHCl ↔ (FeOH+) + (Cl-), а затем (FeOH+) ↔ (Fe2+) + (OH-).
Некоторые соли под действием температуры могут разлагаться. Например, при нагревании из карбоната кальция СаСO3 получается оксид кальция СаO и кислотный оксид СО2. Солевые вещества, образованные от бескислородных кислот, разлагаются на простые элементы: хлорид серебра AgCl распадается на серебро Ag с выделением хлора Cl. Если солеобразующим соединением выступает кислота с сильными окислительными свойствами, то разложения до простых элементов не происходит: 2КNO3 → 2КNO2 + O2.
Взаимодействие с оксидами и кислотами
Соли реагируют путем сплавления с кислотными или амфотерными оксидами. При этом образуется новое солевое соединение, а оксиды замещаются менее летучими. С основными оксидами такая реакция не происходит. Например, карбонат калия K2CO3 сплавляется с оксидом кремния (IV) SiO2 с образованием силиката калия KSiO3 и выделением углекислого газа CO2: K2CO3 + SiO2 → KSiO3 + CO2↑. K2CO3 может взаимодействовать и с оксидом алюминия, при этом получается алюминат калия KAlO2 и углекислый газ CO2: K2CO3 + Al2O3 → 2KAlO2 + CO2↑.
Взаимодействие с кислотами может происходить только в том случае, если в реакцию вступает кислота и соль, образованная более слабой кислотой. Показателем возможного совместного реагирования солей с кислотами могут быть предполагаемые:
- осадок;
- вода;
- газообразное вещество;
- слабый электролит.
Например, нерастворимое соединение угольной кислоты карбонат магния MgCO3 вступает в реакцию с сильной серной кислотой: MgCO3 + H2SO4 → MgSO4 + 2H2O + CO2. Растворимый силикат калия как производное кремниевой кислоты может взаимодействовать с соляной кислотой, потому что в ходе реакции ожидается получение нерастворимой кремниевой кислоты: K2SiO3 + 2HCl → H2SiO3↓ + 2KCl.
Реакции с основаниями и другими солями
Со щелочами взаимодействуют в основном только соли аммония и тяжелых металлов, если при этом они относятся к растворимым. В результате получают новое солевое вещество и новое основание. Например, в реакцию с гидроксидом калия KOH вступает сульфат меди (II) CuSO4, в результате чего образуется сульфат калия K2SO4, а гидроксид меди Cu (OH) выпадает в осадок: 2KOH + CuSO4 → K2SO4 + Cu (OH)2.
Взаимодействие хлорида аммония с гидроксидом натрия описывается таким уравнением (NH4)2SO4 + 2KOH → 2H2O + K2SO4 + 2NH3↑. Если воздействовать основанием на кислую соль, то в результате получится средняя соль и вода. Например, гидрокарбонат натрия NaHCO3 взаимодействует с гидроксидом натрия NaOH: NaHCO3 + NaOH → Na3CO3 + H2O.
Реакции между солями возможны только в случае хорошей растворимости обоих веществ, при этом образуются две новые соли. С нерастворимым соединением взаимодействие не случается. Некоторые вещества, относящиеся к кислым, реагируют со слабокислыми солями и со своими средними соединениями.
Получение и применение
Многие соединения солей всех видов встречаются в виде залежей минеральных пород и рассолов. Например: известняк, разные виды селитры, поваренная и калийная соли, сильвин, карналлит, натрон, мирабилит и многие другие. Условно все способы получения солевых веществ разделяют на физическую переработку сырья (выпаривание, кристаллизация, флотация и тому подобное) и извлечение их из полупродуктов, отходов других производств и минералов химическими способами, основанными на свойствах солей.
Больше всего химическая промышленность выпускает солей для сельского хозяйства, причем они используются как в качестве удобрений для хорошего роста растений и повышения урожайности, так и для их защиты от сорняков и вредителей. Минеральные соли используют и как сырье для производства самых разнообразных химических веществ, применяемых в таких отраслях:
- производство целлюлозы и бумаги;
- лакокрасочная промышленность;
- моющие средства;
- стекловарение;
- обработка кожи.
В качестве присадок и плавней соли применяются в металлургии для обогащения руд и при выплавке металлов. Производство цемента, одного из самых важных для строительной промышленности компонента, невозможно без известняка. Соли хрома используются при изготовлении огнеупорных материалов. Весь спектр разновидностей солей применяется и в фармацевтической промышленности.
Источник статьи: http://nauka.club/khimiya/soli-v-khimii.html
Урок 25. Соли
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
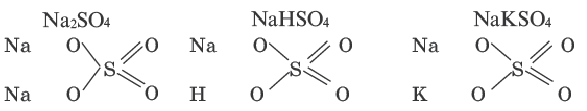
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник статьи: http://himi4ka.ru/arhiv-urokov/urok-25-soli.html
Соли в химии – классификация, получение, свойства, формулы и определения с примерами
Понятие о солях:
В предыдущем параграфе продукты замещения атомов водорода атомами металла имели формулы
Для этого разделим каждую формулу черточкой на две части:
Легко заметить, что первая составная часть формулы представлена металлическими элементами, а вторая — кислотными остатками. Кроме рассмотренных примеров, существует много веществ, формулы которых содержат металлические и кислотные остатки. Все они относятся к классу соединений, который получил название соли.
Соли — это сложные вещества, образованные атомами металлов и кислотными остатками
В отличие от кислот, представители класса солей имеют немолекулярное строение, их структурными частями являются ионы — катионы металлов и анионы кислотных остатков.
Формулу солей в общем виде можно записать так:
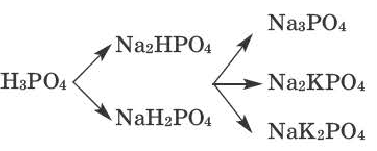
Номенклатура солей
Номенклатура солей (речь пойдет о так называемых средних солях, которые соответствуют приведенной общей формуле и являются продуктами полного замещения атомов водорода в кислоте). Название солей состоит из двух слов: названия металлического элемента и названия кислотного остатка в именительном падеже, например 
Если металл имеет переменную валентность, ее указывают в круглых скобках после его символа без интервала, например: 
Кроме современных названий солей, которые отвечают указанным правилам, за некоторыми солями сохранились исторические названия, например: 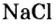
Определение валентности металлов в формулах солей и составление формул солей по валентности. Определяя валентность металла в формуле соли или составляя формулы солей, придерживаются общего правила, как при определении валентности элементов в бинарных соединениях и составлении их формул.
Сумма единиц валентности одной части формулы соли (атомов металла) равна сумме единиц валентности второй ее части (кислотного остатка).
Определить валентность хрома в солях, формулы которых: 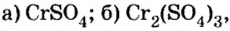
Обе соли содержат двухвалентный кислотный остаток серной кислоты.
Сумма единиц валентности кислотного остатка в первой формуле равна 2. Такой же должна быть и сумма валентностей атомов хрома. Поскольку атом хрома в этой формуле один, то обе валентности принадлежат ему. Следовательно, хром в формуле 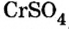
Во второй формуле кислотных остатков — три. Поэтому сумма единиц их валентностей составляет 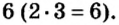
Ответ:
Составить формулу нитрата алюминия.
1. Записываем символы металла и кислотного остатка:
2. Над металлом и кислотным остатком проставляем валентность:
3. Для единиц валентности металла и кислотного остатка находим наименьшее общее кратное: это число 3.
4. Делением общего кратного 3 на валентность металла и кислотного остатка находим индексы:
а) 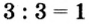
б) 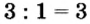
Полученные индексы вписываем в формулу нитрата алюминия:
Ответ:
Из общей формулы солей следует, что индекс металла совпадает с валентностью кислотного остатка, а индекс кислотного остатка — с валентностью металла. Однако, как и у оксидов, в формулах кислот четных индексов нет. Поэтому при составлении формул кислот по валентности проводят сокращение четных индексов.
Физические свойства солей
При нормальных условиях соли находятся только в твердом состоянии. Это тугоплавкие кристаллические вещества, поэтому, чтобы перевести их в жидкое состояние, а тем более в парообразное, нужны высокие температуры. Так, температура плавления сульфида бария равна
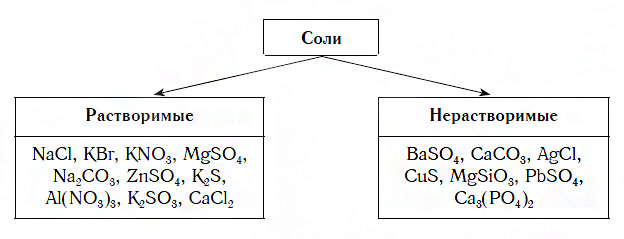
По способности растворяться в воде соли делят на растворимые (хлорид натрия, нитрат калия), малорастворимые (сульфит магния, хлорид свинца 
Соли — это вещества без запаха, разного вкуса. Может показаться, что класс веществ «Соли» получил такое название благодаря соленому вкусу его соединений. В действительности же с «чистым» соленым вкусом существует лишь одна соль, и вам она хорошо известна, это — хлорид натрия. Врачи предостерегают от избыточного употребления поваренной соли, однако в жизненно необходимых порциях хлорида натрия нуждается организм и человека, и животных. Она нужна для поддержания состава крови, а также вырабатывания желудочного сока. Физраствор, который используется для лечения больных,— ничто иное, как раствор хлорида натрия.
Соли бериллия — сладкие на вкус, соли магния — горькие, карбонат кальция (мел) — безвкусный. В большинстве своем соли имеют смешанный вкус — кисло-сладкий, горько-соленый.
Помните! В химическом кабинете соли ни в коем случае не пробуют на вкус!
Большинство солей белого цвета. Цвет перманганата калия 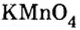
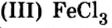
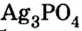
Внимательно рассмотрите образцы солей, которые учитель демонстрирует вам на урюке, и определите цвет и растворимость каждой из них.
- К классу солей относятся сложные вещества, образованные атомами металлов и кислотными остатками.
- В формулах солей сумма единиц валентности металла равна сумме единиц валентности кислотного остатка.
- Составляя формулу соли, необходимо знать валентность металла и кислотного остатка.
- По современной номенклатуре, названия солей образуют из названия металла и названия кислотного остатка и проставляют валентность металлов, у которых она имеет несколько значений.
Наиболее распространенной из солей угольной кислоты является карбонат кальция 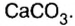
Жемчужина формируется в раковине моллюска вокруг раздражителей — чаще всего песчинок — и приблизительно за 12 лет вырастает величиной с горошину. Большие жемчужины правильной формы — чрезвычайная редкость.
Жемчуг издавна используют в качестве украшений. Особенно ценятся жемчужины правильной шарообразной формы. Они очень дорогостоящие: жемчужина диаметром 1 см стоит около 4000 долларов.
Средняя продолжительность хранения жемчужин составляет от 250 до 500 лет, после чего они теряют блеск и их легко измельчить в порошок.
Скелет других водных обитателей — коралловых полипов — по составу близок к жемчугу. Большие скопления коралловых полипов образуют коралловые рифы. В результате археологических раскопок обнаружилось, что люди издавна изготавливают украшения из кораллов (так называется скелет коралловых полипов). Благодаря несколько иному составу, чем у жемчужин, такие изделия сохраняются дольше. В зависимости от содержания органических веществ, кораллы бывают разного цвета: розовые, красные и даже черные. Изготовленные из таких кораллов украшения — ожерелья, серьги, кольца — считаются самыми дорогими. Владельцам кораллов нужно знать, что даже при легком нагревании эти драгоценности теряют свой цвет.
Что такое соли
К классу солей принадлежит соединение, которое мы употребляем ежедневно вместе с пищей. Это — поваренная соль 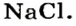
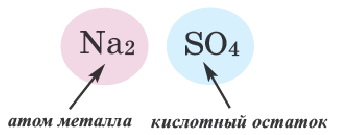
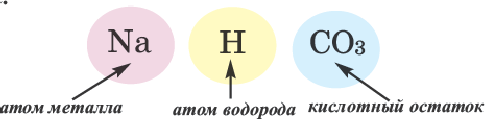
Соль — соединение, в состав которого входят катионы металлического элемента и анионы кислотного остатка.
Ион кислотного остатка имеет отрицательный заряд; его значение совпадает со значением валентности этого остатка:
- кислота
- кислотный остаток
- анион кислотного остатка
Формулы солей. Для солей, как и кислот, существуют две общие формулы — 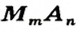
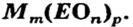
Примеры формул солей
Для того чтобы составить формулу соли, необходимо знать заряды катиона и аниона, а также учитывать то, что соединение электро-нейтрально. Для выяснения значений зарядов ионов можно использовать таблицу, размещенную на форзаце 2 (так называемая таблица растворимости).
Составим формулу соли, которая содержит катионы 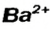
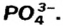
Графические формулы для солей, как и для других ионных соединений, не составляют.
Названия солей
Для каждой соли существует химическое название, а для некоторых солей — еще и тривиальные названия (табл. 2). Химическое название соли состоит из двух слов. Первое слово — название металлического элемента, а второе происходит от химического названия соответствующей кислоты.
Формулы и названия некоторых солей
Если элемент имеет переменную валентность, то ее значение указывают после названия элемента (табл. 2, рис. 12). Склоняется только второе слово химического названия соли.
Существуют соли, образованные только неметаллическими элементами. В их состав входят катионы аммония 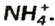
— аммоний хлорид;
— аммоний сульфат;
— аммоний нитрат.
Два последних соединения применяют в качестве азотных удобрений.
Соли аммония происходят от основания 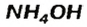
Распространенность в природе
В земной коре содержится много солей (рис. 13). В основном, это силикаты. Среди них встречаются и драгоценные камни: голубой топаз (алюминий силикат), золотистый циркон (цирконий силикат), бесцветный фенакит (бериллий силикат) и др.

Существует много залежей натрий хлорида NaCl (каменная соль), калий хлорида КС1, кальций карбоната СаС03 (мел, мрамор, известняк). Последнее соединение составляет основу ракушек, яичной скорлупы (рис. 14). Сульфиды 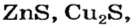
Различные соли находятся в растворенном состоянии в гидросфере. В морской воде преобладают хлориды Натрия и Магния, а в пресной — соли Кальция и Магния (в основном карбонатной и сульфатной кислот).
Соль — ионное соединение, в состав которого входят катионы металлического элемента и анионы кислотного остатка. Для солей существуют общие формулы
Каждая соль имеет химическое название, а некоторые соли — еще и тривиальные названия. Соли очень распространены в природе.
Свойства и применение солей
Физические свойства солей: Соли, как и другие ионные соединения, при обычных условиях являются кристаллическими веществами. Они обычно имеют высокие температуры плавления:
Часть солей растворяется в воде, некоторые являются малорастворимыми (рис. 31), а остальные — нерастворимые. Соответствующая информация помещена в таблице растворимости (форзац 2).
Образование растворов солей часто сопровождается тепловыми эффектами. Например, при растворении натрий карбоната выделяется небольшое количество теплоты и раствор немного нагревается. А во время приготовления раствора натрий нитрата можно зафиксировать незначительное понижение температуры.
Лишь одна соль — натрий хлорид — имеет соленый вкус. Многие другие растворимые соли горькие, а соли Плюмбума и Бериллия сладкие, но чрезвычайно ядовитые. Определяя вкус различных солей, некоторые алхимики, вероятно, поплатились за это жизнью.
Соли по-разному влияют на растения, животных, человека. Среди них есть соединения, которые содержат необходимые для растений элементы; их применяют в качестве удобрений. А поваренную соль мы ежедневно употребляем вместе с пищей, чтобы пополнить ее запасы в организме (это соединение постоянно выводится из организма вместе с потом и мочой).
Химические свойства солей: Соли вступают в разнообразные реакции с простыми и сложными веществами.
Реакции с металлами
Соль в водном растворе может реагировать с металлом с образованием новой соли и другого металла (рис. 32). Часто говорят, что один металл «вытесняет» другой из раствора соли. Реакция происходит, если металл-реагент активнее, чем металл-продукт, т. е. находится в ряду активности слева от него (форзац 2):
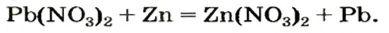
Изучая основания и кислоты, вы узнали о реакциях этих соединений с солями. Кроме того, соли также могут взаимодействовать друг с другом. Все упомянутые реакции относят к реакциям обмена.
Реакции со щелочами
Реакция между солью и щелочью происходит лишь в растворе (нерастворимые соли со щелочами не взаимодействуют). Она возможна, если один из ее продуктов — основание или соль — выпадает в осадок (рис. 33):
Для прогнозирования возможности таких реакций используют таблицу растворимости (форзац 2).
Если к раствору купрум(II) сульфата добавить столько раствора щелочи, сколько необходимо для полного превращения соли в купрум(II) гидроксид, то после отстаивания над осадком увидим бесцветный раствор. Он будет содержать лишь натрий сульфат (ионы 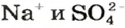
Реакции с кислотами
Соль (как растворимая, так и нерастворимая) может взаимодействовать с кислотой с образованием новой соли и новой кислоты. Такие реакции часто сопровождаются выделением осадка (рис. 34) или газа
но иногда остаются незаметными:
Случаи, в которых реакция между солью и кислотой возможна, указаны в §12(с. 81).
Реакции с другими солями
Взаимодействие между двумя солями происходит лишь в растворе (реагенты должны быть растворимыми в воде) с образованием двух новых солей. Реакция возможна, если один из ее продуктов выпадает в осадок (рис. 35), т. е. является нерастворимым или малорастворимым соединением.
Примеры реакций между двумя солями:
Термическое разложение солей
Оксиген-содержащие соли, образованные газообразными, летучими или неустойчивыми оксидами, при нагревании разлагаются. Продуктами этих реакций, как правило, являются два соответствующих оксида:
Нитраты, как и нитратная кислота, происходят от нитроген(V) оксида 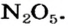
Соли щелочных элементов либо не разлагаются (карбонаты, сульфаты), либо их разложение происходит своеобразно. Некоторые из таких реакций используют в лаборатории для получения кислорода:
Изложенный материал обобщен в схеме 5.
1 – Так разлагаются нитраты металлических элементов от Магния до Купрума включительно (см. ряд активности металлов).
Применение солей
Многие соли применяются на практике. Натрий хлорид является сырьем для промышленного получения хлора, хлоридной кислоты, натрий гидроксида, соды. Это соединение незаменимо для приготовления пищи, консервирования. Хлорид, сульфат, нитрат Калия, фосфаты Кальция, некоторые другие соли применяют в качестве минеральных удобрений (рис. 36). Кальций карбонат в виде камня известняка используют в строительстве, а на заводах из него производят известь.
На основе искусственно полученной соли изготовляют зубную пасту. В школе пишут на доске мелом, а это — также кальций карбонат. Кальций сульфат (гипс) применяют в строительстве и медицине. Простым средством для мытья и чистки посуды, предметов домашнего обихода, смягчения воды перед стиркой является кальцинированная сода, или натрий карбонат. Кальцинированную соду вместе с мелом или известняком используют в производстве стекла.
Соли — ионные вещества. Они имеют высокие температуры плавления, различную растворимость в воде.
Соли взаимодействуют с металлами с образованием другой соли и другого металла. Такие реакции происходят, если металл-реагент более активный, чем металл-продукт (это определяют с помощью ряда активности металлов).
Соли вступают в реакции обмена со щелочами, кислотами, другими солями. Некоторые оксигенсодержащие соли при нагревании разлагаются на соответствующие оксиды. Многие соли используются на практике.
Кислые соли
Вы знаете, что при реакции кислоты со щелочью атомы Гидрогена каждой молекулы кислоты «заменяются» атомами (точнее — ионами) металлического элемента:
А возможна ли замена только части атомов Гидрогена в молекуле многоосновной кислоты? Да. В результате соответствующих реакций образуются так называемые кислые соли:
Кислые соли 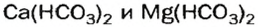
и на стенках сосуда образуется накипь — смесь карбонатов 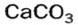
Кислые соли Кальция и ортофосфатной кислоты 
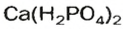

Способы получения солей
Соли можно получать значительно большим количеством способов, чем оксиды, основания или кислоты.
Три способа получения солей предполагают проведение химических реакций с участием металлов.
Способ 1: металл + неметалл 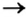
Способ 2: металл + кислота (раствор) 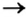
В такие реакции вступают сульфатная (в разбавленном растворе), хлоридная, некоторые другие кислоты и металлы, находящиеся в ряду активности слева от водорода:
Способ 3: металл 1 + соль 1 (в растворе) 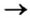
Вам известно, что такая реакция возможна, если металл 1 активнее металла 2, т. е. металл 1 находится в ряду активности слева от металла 2:
Несколько других способов получения солей предусматривают использование реакций между соединениями, которые проявляют основные и кислотные свойства (§ 9, 11 —13).
Способ 4: основание (амфотерный гидроксид) + кислота (амфотерный гидроксид) 
Способ 5: основный (амфотерный) оксид + кислотный (амфотерный) оксид 
Способ 6: основание + кислотный (амфотерный) оксид 
Способ 7: кислота + основный (амфотерный) оксид 
Соли также получают с помощью реакций обмена с участием солей (§ 14).
Способ 8: соль 1 + кислота 1 
Способ 9: соль 1 + щелочь 
Способ 10: соль 1 -I- соль 2 —> соль 3 + соль 4 (рис. 43):
Это интересно. Солис 
Способы 5 и 6 непригодны для получения солей безоксигеновых кислот, поскольку эти кислоты не имеют кислотных оксидов.
Выбирая способы 8—10, учитывают то, что реакция обмена возможна в случае образования осадка, газа или слабой кислоты (§11, 12, 14).
Вышеизложенное обобщено в схеме 9.
Предложить максимальное количество способов получения магний сульфата
Магний сульфат — оксигенсодержащая соль. Поэтому способ 1 для получения соединения не подходит.
Эту соль можно получить, исходя из металла (способы 2 и 3):
Магний сульфат может образоваться в результате реакций между соответствующими соединениями основного и кислотного характера (способы 4—7):
Для реакции соли с кислотой (способ 
Реакция соли со щелочью (способ 9) для получения магний сульфата не подходит, поскольку одним из реагентов должен быть гидроксид 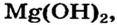
Магний сульфат растворяется в воде. Учитывая это, выберем для реакции между двумя солями (способ 10) такие реагенты:
Соли получают несколькими способами. Часть способов основана на реакциях металлов с неметаллами, кислотами, солями. Другие способы предусматривают осуществление реакций между соединениями с основными и кислотными свойствами, а также реакций обмена с участием солей.
Химические свойства солей
Соли, как и другие классы неорганических соединений, способны участвовать в химических реакциях.
Взаимодействие солей с металлами
Соли (в растворе) взаимодействуют с металлами, расположенными в вытесни-тельном ряду до того металла, из атомов которого они образовались. В результате реакции образуются новая соль и металл.
Опыт 1. Четыре химических стакана наполним растворами солей: два — сульфатом меди 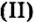
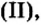
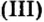
В реакции, которая состоялась, атомы простого вещества замещают атомы металлического элемента в сложном веществе. Поэтому эта реакция относится к реакциям замещения. Результаты опыта согласовываются с местом в вытеснительном ряду металлов, взятых для проведения опыта.
Взаимодействие солей с основаниями (щелочами)
В предыдущем параграфе вы узнали о том, что единственный способ, которым можно получить нерастворимое основание определенного металлического элемента,— это взаимодействие его растворенной в воде соли со щелочью. Такое взаимодействие мы рассматривали и при изучении свойств щелочей. Поэтому вспомним, что для протекания реакции вещества должны находиться в растворенном состоянии, а один из образовавшихся продуктов реакции — выпадать в осадок, например:
Взаимодействие солей с кислотами
Соли вступают в реакцию обмена с кислотами при условии, что среди продуктов реакции есть осадок или газ. (Вспомните взаимодействие соляной кислоты с нитратом серебра или питьевой соды — с уксусной кислотой.) Проведем соответствующие опыты.
Опыт 2. К раствору хлорида бария 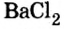
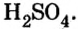
Среди образовавшихся продуктов нерастворимым веществом является сульфат бария.
Взаимодействие солей с солями
Повторим опыт 2, заменив серную кислоту на одну из ее растворимых солей.
Опыт 3. К раствору сульфата натрия 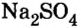
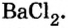
С помощью раствора хлорид бария или другого растворенного в воде соединения бария можно обнаружить в растворе серную кислоту и ее соли.
Опыт 4. К раствору карбоната натрия добавим раствор азотной кислоты. Наблюдается выделение газообразного вещества. Поднесенная к отверстию пробирки зажженная спичка гаснет. Следовательно, выделяется углекислый газ:
Для формулировки окончательного обоснованного вывода о химических свойствах солей проведите химический эксперимент, предусмотренный лабораторными опытами 7, 8, 9.
- Взаимодействие солей с другими веществами происходит в растворе.
- Одним из продуктов взаимодействия солей с другими веществами всегда является соль.
- Соли проявляют такие типичные химические свойства:
- Соли серной кислоты можно обнаружить в растворе с помощью растворов солей бария.
Соли, при образовании которых в молекуле кислоты все атомы водорода замещаются атомами металла, получили название средних солей. Средние соли не содержат ни атомов водорода, ни гидроксильных групп, а в их состав входят атомы одного металлического элемента, например:
Кроме средних, существуют еще и другие соли, в частности кислые, основные, двойные.
Кислые соли являются продуктом неполного замещения атомов водорода в молекуле кислоты на металл. Поэтому кислотные остатки таких солей содержат атомы водорода, например:
В молекулах серной и ортофосфорной кислот замещен на металл 1 атом водорода, поэтому остатки 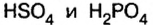



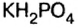
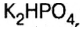
Основными называют соли, полученные частичной нейтрализацией основания кислотой (например, 
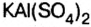
Какая образуется соль — средняя, кислая или основная — зависит от количества взятых для проведения реакции реагентов.
Соли в природе
По распространенности неорганических соединений в природе соли занимают второе место после оксидов. Так, горные породы и глина состоят из солей кремниевой кислоты, которые имеют сложное строение. Их формулы записывают с помощью формул оксидов, например формула полевого шпата — 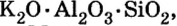
Местонахождение залежей солей в Украине представлено на рисунке 15.
Наиболее известная вам соль — хлорид натрия 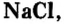
Как сырье хлорид натрия используется для производства гидроксида натрия, натрия, хлора, соляной кислоты, мыла, синтетических моющих средств. В пищевой, кондитерской и фармацевтической промышленности используют такие соли: хлорид натрия, карбонат натрия, нитрат натрия, сульфат магния и другие.
Карбонат кальция 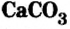
Кости позвоночных животных и человека содержат ортофосфат кальция 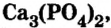
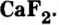
Соли входят также в состав крови, клеточного сока, нервной и мускульной тканей.
Из курсов природоведения и ботаники вам известно, что для полноценного роста и развития растениям нужны химические элементы калий, азот, фосфор. Их вносят в почву в виде минеральных удобрений. По своему составу почти все минеральные удобрения — это соли, в частности
Широко применяется и соль сульфата кальция 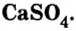
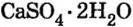
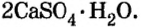
Карбонат натрия 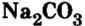
В плавательных бассейнах цвет воды обусловлен наличием в ней сульфата меди 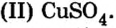
Хлорид калия 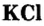
Из ортофосфата кальция 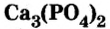
Сульфат бария 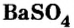
Ознакомившись с рисунком 16, вы пополните знания о применении солей новыми сведениями.
Приведенные здесь примеры — лишь небольшая часть того, как используются соли.
-калийное удобрение
– производство фосфорных удобрений, ортофосфорной кислоты
– в фотографии и серебрении
– производство удобрений и взрывчатых веществ; средство для консервирования в пищевой промышленности
– удобрение; в производстве черного пороха, спичек
– сырье для получения
в качестве консервирующего и лекарственного средства; пищевой продукт -поваренная соль
– очистка воды; крашение кожи; в проклеивании бумаги
– производство красок; в качестве наполнителя в производстве бумаги и каучука; рентгено-контрастный материал в медицине
– средство защиты растений; производство ацетатного волокна; в покрытии медью металлических изделий; получение меди высокой чистоты
– сырье для получения других солей
производство стекла, мыла, синтетических моющих средств, эмалей;средство для устранения жесткости воды.
– строительный материал; для изготовления оттисков форм, статуэток и др.; для наложения повязок при переломах
– разрыхлитель теста; в производстве фотографических проявителей
– фосфорное удобрение
- Соли относятся к распространенным в природе сложным неорганическим веществам, среди которых больше всего хлоридов, силикатов, карбонатов, сульфатов, ортофосфатов.
- Часть солей используется непосредственно после добычи, а часть поддается химической переработке с целью получения новых веществ.
- Соли находят самое разнообразное применение в химической промышленности и многих других отраслях народного хозяйства, а также в быту.
Вода морей и океанов из-за содержащихся в ней различных солей на вкус солено-горькая. 100 г морской воды в среднем содержат 3,5 г солей, среди которых хлорида натрия почти 78 %. Моря и океаны имеют разную соленость — YaK называют содержание солей в единице объема морской воды. Однако состав солей в морской воде практически одинаков. Поэтому ученые считают, что Мировой океан в давние времена был единым.
Морские растения и животные приспособились к жизни в соленой воде. Более того, в их организмах накапливаются ионы, которые входят в состав солей морей и океанов. Морепродукты богаты кальцием, кремнием, иодом, медью, магнием, фосфором и другими элементами.
Используя сведения из географии и различных информационных источников, подготовьте рассказ (сообщение, реферат) о распространении какой-либо соли в природе и ее использовании.
Поработайте самостоятельно с дополнительной литературой, Интернетом и выясните, на каких химических свойствах солей основывается производство из них других веществ. Рассказ подтвердите примерами.
Справочный материал по солям
Соли можно получить многими способами:
1) взаимодействием металла с кислотой:
Вспомните особенности взаимодействия кислот с металлами. Для получения солей каких металлов можно применить этот способ?
2) взаимодействием оксида металла с кислотой:
3) взаимодействием гидроксида металла с кислотой:
4) взаимодействием соли с кислотой:
5) взаимодействием основного или амфотерного оксида с кислотным оксидом:
6) взаимодействием металла с раствором соли другого металла:
7) взаимодействием металла с неметаллом (получают соли бескислородных кислот):
- В результате химических реакций образуются различные соединения. Это позволяет из соответствующих реагентов получать необходимые вещества.
- К общим способам получения оксидов относятся: окисление простых и сложных веществ, разложение нерастворимых гидроксидов при нагревании и др.
- К общим способам получения растворимых оснований (щелочей) относятся: взаимодействие металлов с водой, взаимодействие оксидов с водой и электролиз (разложение) растворов солей бескислородных кислот.
- Нерастворимые основания получают взаимодействием раствора их соли с раствором щелочи.
- Соли получают взаимодействием простого вещества (металла), сложных веществ (оксида металла, гидроксида металла, соли) с веществами, в состав которых входит кислотный остаток (кислота, соль), а также взаимодействием кислотных оксидов с основными оксидами или щелочами.
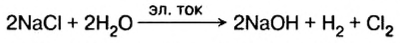
В лаборатории щелочь можно получить из металла и из оксида. Но чистых металлов натрия, калия, кальция, бария и их оксидов в природе не существует. Поэтому этими способами получают щелочи лишь в лабораториях. Чтобы обеспечить щелочами различные производства, нужны другие способы их получения из природного сырья. Впервые щелочь была получена электролизом (разложением постоянным электрическим током) раствора соли хлорида натрия. Электролиз стал основным промышленным способом производства щелочей гидроксида натрия и гидроксида калия.
Как происходит электролиз, вы будете изучать позже. А пока запишем суммарное уравнение электролиза водного раствора хлорида натрия:
Из записи уравнения видно, что из доступных природных веществ — поваренной соли и воды — получают три новых вещества, которых в природе нет, но каждое из них используется в промышленности, а значит есть потребность в их получении.
Классификация
| Химическая формула | Название | Тип соли |
| (CuOH)2CO3 | ? | ? |
| Fe2(SO4)3 | ? | ? |
| (NH4)2Cr2O7 | ? | ? |
| BaClNO3 | ? | ? |
| NaKSO4 | ? | ? |
Какие соли вам известны ? Как можно отличить соли друг от друга?
Соли получаются в результате замещения атомов водорода в молекуле кислоты атомами металла, а в основаниях гидроксильной группы (ОН . ) кислотными остатками.
 |
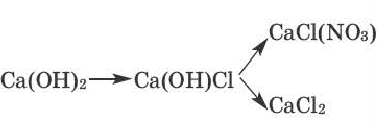 |
Солями называются вещества, в составе которых содержатся атомы металла (или аммония) и кислотный остаток. Соли классифицируют по их составу.
Графические формулы
Нормальные, кислые и двойные соли рассматриваются как продукты замещения атомов водорода в молекуле кислоты атомами металла.
Основные же соли рассматриваются как продукты замещения гидроксильной группы кислотным остатком.
Номенклатура
Нормальные соли. Соли, полученные в результате полного замещения атомов водорода, относящихся к основности кислот, атомами металлов, называются нормальными солями.
При наименовании нормальных солей, если металл обладает постоянной валентностью, то вначале дается название кислотного остатка, а затем название металла. Если же металл имеет переменную валентность, то вначале дается название кислотного остатка, следом название металла и его валентность (в скобках римскими цифрами).
| Нормальная соль | Название | Нормальная соль | Название |
| Ah(SO4)3 | Сульфат алюминия | FeSO4 | Сульфат железа (II) |
Кислые соли
Соли, полученные в результате частичного замещения атомов водорода, относящихся к основности кислоты, атомами металлов (или же сложными ионами, например, ионами аммония), называются кислыми солями.
При наименовании кислых солей вначале дается название кислотного остатка с указанием на греческом количества атомов водорода, относящихся к основности кислоты и не замещенных металлом, с приставкой «гидро». При одном атоме водорода приставка «моно» не употребляется.
| Кислые соли | ||||
| Гидросоли | Дигидросоли | |||
| Формула | Название | Формула | Название | |
| CaHPO4 | гидроортофосфат кальция | NH4H2PO4 | дигидроортофосфат аммония | |
Основные соли
Соли, полученные в результате частичного замещения гидроксильных групп оснований кислотными остатками, называются основными солями.
Как и нормальные соли, при наименовании основных солей к кислотным остаткам здесь добавляется приставка «гидроксо» с указанием на греческом количества гидроксильных групп (ОН), не замещенных кислотным остатком. Если гидроксильная группа одна, то приставка «моно» не употребляется.
| Основные соли | ||||
| Гидросоли | Дигидросоли | |||
| Формула | Название | Формула | Название | |
| Al(OH)Cl2 | гидроксохлорид алюминия | Al(OH)2Cl | дигидроксохлорид алюминия | |
Двойные соли. Соли, полученные в результате замещения атомами двух разных металлов атомов водорода, относящихся к основности кислот в многоосновных кислотах, называются двойными солями.
При наименовании двойных солей после названия кислотного остатка даются оба названия металлов.
| Двойная соль | Название | Двойная соль | Название |
| NaKCO3 | карбонат натрия-калия | Na2KPO4 | ортофосфат динатрия-калия |
Смешанные соли
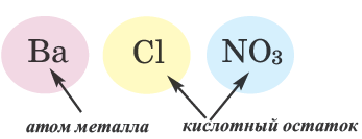
Соли, полученные в результате замещения гидроксильных групп в многокислотных основаниях двумя различными кислотными остатками, называются смешанными солями.
Если в составе смешанных солей содержатся бескислородные и кислородсодержащие кислотные остатки, то вначале даются названия бескислородных, а затем кислородсодержащих кислотных остатков.
| Смешанная соль | Название | Смешанная соль | Название |
| CaCl(OCl) (или CaOC2) | Хлорид гипохлорит кальция | BaClNO3 | хлорид нитрат бария |
Получение
При взаимодействии металлов с неметаллами
2Fe + ЗСЕ 
2Na + Cl2 
При взаимодействии металлов с солями. Начиная с элемента Mg в ряду активности металлов, каждый металл вытесняет последующие металлы из растворов их солей.
Zn + CuSO4 → ZnSO4 + Cu
При взаимодействии солей с солями. Такие реакции протекают в растворе в том случае, если обе исходные соли растворимы в воде и при их взаимодействии получится нерастворимая в воде соль.
Ca(NO3)2 + Na2CO3 → CaCO3↓ + 2NaNO3
Соли не вступают в реакцию с нерастворимыми в воде солями и основаниями.
Ca(NO3)2 + Cu(OH)2 
При взаимодействии однокислотных оснований с одноосновными кислотами, независимо от количества их молей, всегда получится нормальная соль.
KOH + HCI → KCl + H2O
При взаимодействии многоосновных кислот с многокислотными основаниями, в зависимости от количества молей веществ, получаются нормальная соль, кислая соль или основная соль. Для этого следует сравнить количество атомов водорода, показывающих основность кислоты, с количеством гидроксильных групп (ОН), выражающих кислотность основания.
| n(H + )=n(OH – ) | 3Ca(OH)2+2H3PO4 →6H2O+Ca3(PO4)2 | нормальная соль |
n(H + ) n(OH – ) n(OH – ) |
Ca(OH)2+2H3PO4 →2H2O+ Ca(H2PO4)2 | кислая соль |
n(H + ) n(OH – ) n(OH – ) |
Fe(OH)3+2H2SO4 →2H2O+Fe(OH)SO4 | основная соль |
При добавлении многоосновной кислоты к смеси двух различных оснований получится двойная соль.
NaOH + KOH + H2SO4 → 2H2O + NaKSO4
При нейтрализации одного многокислогного основания двумя различными кислотами получится смешанная соль.
Ca(OH)2+ HCl + HBr → CaClBr+ 2H2O
Физические и химические свойства солей
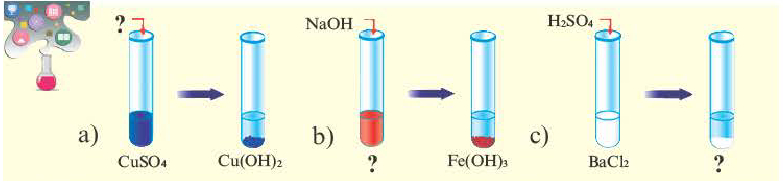
Определите вещества в соответствии с вопросительными знаками. Какие из представленных солей нерастворимы в воде?
Соли это твердые вещества с разной способностью к растворению и цветом. Все соли натрия (Na), калия (К) и аммония (NH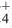
Ca3(PO4)2 → CaHPO4 → Ca(H2PQ4)2 
увеличивается растворимость
Солям в основном присуща высокая температура плавления и кипения.
| Растворимость солей в воде | |
| Нерастворимые и малорастворимые | Растворимые |
| СaS04, BaS04, SrS04, PbS04, Ag2S04 | Остальные сульфаты растворяются в воде |
| AgCl, PbCl2, Hg2Cl2 | Другие хлориды растворяются в воде |
| FeS, CuS, PbS, ZnS и др. | Na2S, K2S, (NH4)2S |
| Другие ортофосфаты не растворяются вводе | Na3PO4, K3PO4, (NH4)3PO4 |
| Другие силикаты не растворяются в воде | Na2SiO3, K2SiO3 |
| Другие карбонаты не растворяются в воде | Na2CO3, K2CO3, (NH4)2CO3 |
| Все соли азотной кислоты, Na, К, NH4 растворяются в воде | |
 Бихромат аммония |
 Перманганат калия |
 Сульфат меди (II) |
 Сульфат железа (II) |
 Хлорид железа (III) |
 Хромат калия |
Химические свойства:
C химическими свойствами солей вы ознакомились при изучении свойств щелочей и кислот, способов получения оксидов и солей.
Кислые, основные, в том числе и двойные соли могут проявлять многие химические свойства нормальных солей. Кроме того, кислые соли легко нейтрализуются щелочами, а основные соли кислотами.
NaHSO4 + NaOH 
Mg(OH)Cl + HCl → MgCl2 + H2O
Основные соли могут взаимодействовать с щелочами.
Al(OH)2Cl+ NaOH → Al(OH)3↓ +NaCl
При нагревании большинства кислых солей (кроме солей аммония) они разлагаются с образованием нормальной соли.
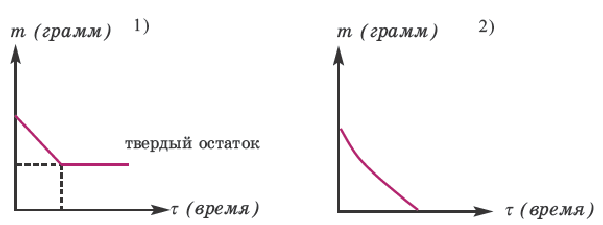
При разложении солей металлов (кроме Hg(NO3)2) всегда выделяется твердый остаток (или оксид металла, или же полученная новая соль в твердом виде). Поэтому разложение этих солей происходит как в 1-ом графике. При разложении большинства аммонийных солей твердый остаток не выделяется. Вот почему их разложение происходит как во 2-ом графике.
Некоторые соли при взаимодействии с водой образуют вещества кристаллогидраты.
При нагревании кристаллогидраты вновь обезвоживаются.
CuSO4 . 5H2O 
синий кристалл белый кристалл
Вода, входящая в состав кристаллов в виде химических соединений, называется кристаллизационной водой. Кристаллогидрат это не просто набор из воды и соли, а вещество. Вода и соль лишь условно разделены точкой.
Многоосновные кислоты, вступая в реакцию соединения с нормальными солями, образуют кислую соль.
Применение солей
Большинство солей широко применяются в промышленности и быту. Так, например, всем хорошо известно применение поваренной соли (NaCl) в быту. В промышленности ее используют при получении гидроксида натрия, соды, хлора, натрия и др. Соли азотной и оргофосфорной кислот в основном считаются минеральными удобрениями.
Многие средства защиты растений от болезнетворных микробов и вредителей, ряд лекарственных препаратов также относятся к классу солей. Более подробные сведения о применении отдельных солей будут представлены при изучении химических элементов.
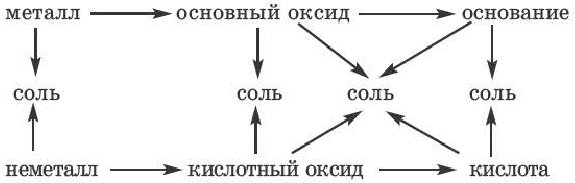
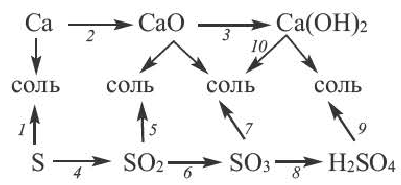
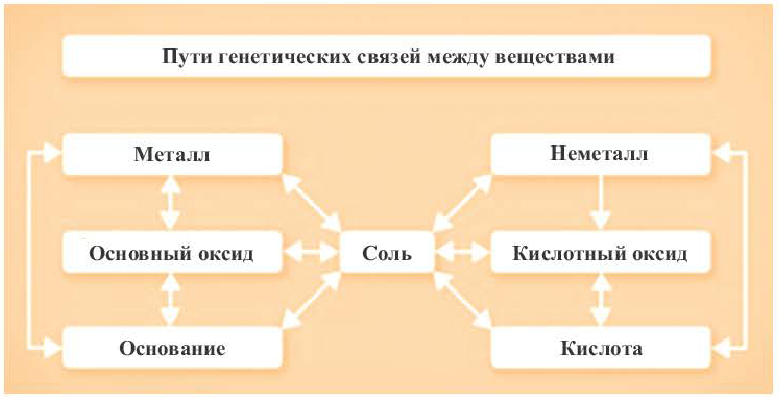
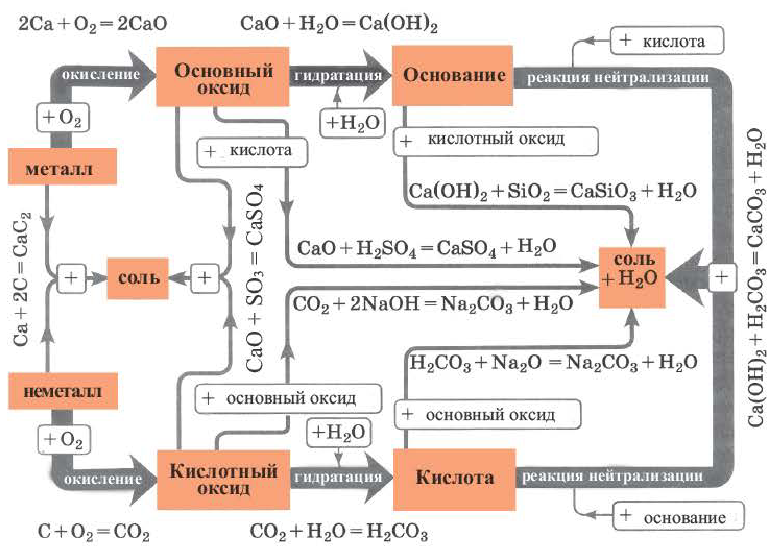
Генетическая связь между классами неорганических соединений
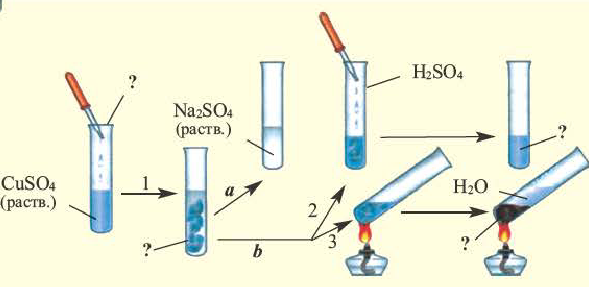
Обратите внимание на пробирки и содержащиеся в них вещества. Определите генетическую связь между этими веществами и запишите уравнения реакций.
Возможность получения из представителей одного класса неорганических соединений представителей другого класса свидетельствует о наличии между ними генетической связи. Взаимосвязь между веществами отдельных классов можно проследить по нижеприведенной схеме:
Получение одного представителя неорганических соединений из другого основывается на их химических свойствах. Приведем один пример относительно генетических связей неорганических соединений.
В качестве примера генетической связи между неорганическими веществами можно привести следующие схемы.
Какие вещества взаимодействуют и с Na2CO3, и с Zn(OH)2?
1) HCl 2) MgSO4 3)K0H 4) Ca(OH)2 5) H2SO4
Решение: Na2CO3, вступая в реакцию с сильными кислотами (HC1, HBr, HI, HNO2, H2SO4, H2PO4), выделяет соль и CO2.
Поскольку Zn(OH)2 является амфотерным основанием, оно вступает в реакцию как с сильными кислотами (HC1, HBr, HI, HNO3, H3PO4, H2SO4), так и с щелочами (NaOH, КОН, Ca(OH)2, Ba(OH)2). В таком случае:
1) Zn(OH)2+ 2HC1 → ZnCl2+ 2H2O
2) Ca(OH)2 + Zn(OH)2 → CaZnO + 2H2O
3) Zn(OH)2+ H2SO4→ ZnSO4+ 2H2O
В то время как Zn(OH)2 вступает в реакцию с КОН, Na2CO3 в эту реакцию не вступает.
C другой стороны, основание Zn(OH)2, находящееся в виде осадка, не вступает в реакцию ни с одной солью.
Ответ: 1, 4, 5
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Хлор в химии
- Сера в химии
- Азот в химии
- Фосфор в химии
- Озон как химический элемент
- Оксиды в химии
- Основания в химии
- Кислоты в химии
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Telegram и логотип telegram являются товарными знаками корпорации Telegram FZ-LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Источник статьи: http://www.evkova.org/soli-v-himii
Соль как химический элемент как пишется
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Соли: классификация, номенклатура, способы получения
“Не в количестве знаний заключается образование,
а в полном понимании и искусном применении того, что знаешь”
А. Дистервег (немецкий педагог)
Мы живем с вами в мире веществ и их превращений, поэтому должны знать не только состав и применение веществ, но и влияние их на организм человека и окружающий нас мир.
С некоторыми классами веществ вы уже знакомы и сегодня приступим к изучению соединений нового класса –солей.
I. Понятие о солях
Такие вещества, как мрамор, известняк, сода, поташ, поваренная соль, адский камень, квасцы и нашатырь, известны людям ещё с древних времён. Однако первые теоретические представления о сходстве их состава возникли только в XVII веке. Именно в это время такие учёные, как Я. Ван Гельмонт (1580–1644), О. Тахений (1620–1699) и Г. Руэль (1703–1770), развили представление о том, что существует отдельный класс веществ — соли, которые можно рассматривать как продукт взаимодействия кислот с основаниями.
Соли – сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков.
Составление формул солей:
II. Классификация солей
Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля (1703–1770). Именно он в 1754 г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
Соли, в состав которых входят металл и кислотный остаток
Соли, в состав которых, кроме металла и кислотного остатка, входят атомы водорода
Соли, в состав которых, кроме металла и кислотного остатка, входят гидроксогруппы ОН
Продукты полного замещения атомов водорода двух- или многоосновной кислоты двумя различными металлами
III. Названия солей
- Для средней соли – название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью. В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония NH4(валентность I).
- Для кислой соли – «гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обратите внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
NaHSO4 – гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
- Для основной соли –«гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
Mg(OH)Cl – гидроксохлорид магния
Fe(OH)(NO3)2 — гидроксонитрат железа(III);
Fe(OH)2NO3 — дигидроксонитрат железа(III).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди(II) (CuOH)2CO3, образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
IV. Получение
1. Из металлов:
металл + неметалл = соль
металл (металлы до Н2) + кислота (р-р) = соль + Н2
Примечание: (металл2 стоит в ряду активности правее)
2.Из оксидов:
кислотный оксид + щелочь = соль + вода
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
3. Реакция нейтрализации:
кислота + основание = соль + вода
4. Из солей:
соль1 + щелочь = нерастворимое основание + соль 2
Примечание: Все реакции обмена протекают до конца, если одно из образующихся веществ нерастворимо в воде (осадок), газ или вода.
Это интересно

V. Тренажеры
VI. Задания для закрепления
Задание №2. Составьте химические формулы солей по их названиям: хлорид железа (II), гидросульфид калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия.
Задание №3. Как двумя способами из оксида кальция можно получить:
Источник статьи: http://kardaeva.ru/88-dlya-uchenika/8-klass/185-soli-klassifikatsiya-nomenklatura-sposoby-polucheniya
Химические свойства и способы получения солей
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей
Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например , оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например , гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например , гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например , гидроксид меди (II) реагирует с серной кислотой:
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например , гидроксид цинка (II) реагирует с соляной кислотой:
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например , аммиак реагирует с соляной кислотой:
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например , соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например , гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например , при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например , гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например , кислород окисляет сульфит натрия до сульфата натрия:
7. Еще один способ получения солей — взаимодействие металлов с неметаллами . Таким способом можно получить только соли бескислородных кислот.
Например , сера взаимодействует с кальцием с образованием сульфида кальция:
8. Соли образуются при растворении металлов в кислотах . Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например , железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например , хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
Химические свойства солей
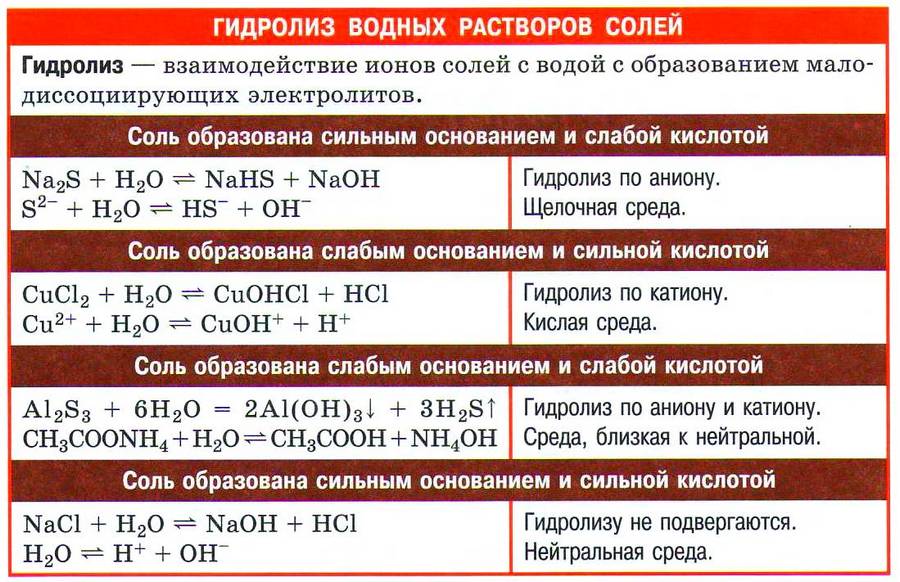
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например , хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например , гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
Например , гидроксокарбонат меди (II) диссоциирует в две ступени:
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Например , сульфат алюминия-калия диссоциирует в одну ступень:
Смешанные соли диссоциируют также одноступенчато.
Например , хлорид-гипохлорит кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например , тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:
2. Соли взаимодействуют с кислотными и амфотерными оксидами . При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например , карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например , сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например , гидрокарбонат калия взаимодействует с гидроксидом калия:
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например , сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например , гидрокарбонат калия взаимодействует с гидросульфатом калия:
Некоторые кислые соли могут реагировать со своими средними солями.
Например , фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:
6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например , железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например , при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например , нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
- Галогениды серебра (кроме AgF):
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
- Карбонаты и гидрокарбонаты:
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
7. Соли проявляют восстановительные свойства . Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например , йодид калия окисляется хлоридом меди (II):
8. Соли проявляют и окислительные свойства . Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
Источник статьи: http://chemege.ru/salts/
Соль как химический элемент как пишется
Генетические ряды металла и неметалла завершает класс солей:
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков. Сoли — это вещества немолекулярного строения. Химическая связь между катионами металлов и анионами кислотных остатков в солях ионная. Формулы солей составляют таким образом, чтобы суммарный заряд ионов металлов и соединенных с ними кислотных остатков был одинаков по величине и противоположен по знаку.
Соли — многочисленный класс соединений. Насколько это понятие применимо для органических соединений?
Лабораторный эксперимент.
Соберите прибор для получения газов и проверьте его герметичность. В пробирку налейте 3—4 мл соляной кислоты и опустите в неё 2—3 небольших кусочка мрамора. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку объёмом 20 мл с 5—6 мл известковой воды. Пропускайте через известковую воду полученный оксид углерода(IV). Что наблюдаете? Продолжайте пропускать углекислый газ до растворения осадка.
Полученную жёсткую воду разлейте в три пробирки.
К содержимому первой пробирки добавьте немного раствора мыла, закройте её пробкой и сильно встряхните. Что наблюдаете?
Вторую пробирку закрепите в пробиркодержателе и нагрейте до кипения. Прекратите нагревание и рассмотрите содержимое.
В третью пробирку добавьте раствор стиральной соды. Что наблюдаете?
При выполнении этого эксперимента были исследованы свойства солей двух типов: средних и кислых.
К первым относятся карбонат кальция СаСO3 (он составляет химическую основу мрамора), хлорид кальция СаСl2, карбонат натрия Na2CO3 (или стиральная сода) и стеарат натрия С17Н35СОONa (мыло).
Напомним, что мыла — это натриевые и калиевые соли жирных кислот: RCOONa — твёрдое мыло, RCOOK — жидкое мыло.
В эксперименте вы также использовали кислые соли — гидрокарбонат кальция Са(НСO3)2 и гидрокарбонат натрия NaHCO3. Запишем уравнения проделанных реакций.
1) Получение углекислого газа:
СаСO3 + 2НСl = СаСl2 + СO2↑ + Н2O
2) Взаимодействие углекислого газа с известковой водой с образованием нерастворимого карбоната кальция:
СO2 + Са(ОН)2 = СаСO3↓ + Н2O
3) Превращение нерастворимого карбоната в растворимый гидрокарбонат:
СаСO3 + СO2 + Н2O = Са(НСO3)2
4) Диссоциация растворимого гидрокарбоната кальция, обусловливающего жёсткость воды:
Са(НСO3)2 = Са 2+ + 2НСО3 –
Жёсткость воды и способы её устранения.
Вода называется жёсткой, если содержит катионы кальция, магния и железа. В жёсткой воде хуже мылится мыло, увеличивается расход стирального порошка, образуется накипь в системах отопления и горячего водоснабжения и т. д.
Умягчение жёсткой воды проводят разными способами:
Различают временную (устраняется кипячением) и постоянную (устраняется добавкой соды и другими способами) жёсткость воды.
Эксперимент показал различия в свойствах средних и кислых солей: карбонат кальция нерастворим, а гидрокарбонат — растворим. Переход гидрокарбоната кальция в карбонат наблюдается и в природе: рост сталактитов и сталагмитов в пещерах.
В повседневной жизни различия свойств кислых и средних солей мы наблюдаем при использовании стиральной, или технической, соды Na2CO3 (умягчает воду; применяется при стирке белья) и питьевой, или пищевой, соды NaHCO3 (применяется в хлебопечении, изготовлении шипучих напитков, для устранения изжоги).
Классификация солей.
Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
Средняя , или нормальная, соль образуется в результате полного замещения катионов водорода в кислоте на катионы металла.
Кислая соль образуется в результате неполного замещения катионов водорода в кислоте на катионы металла.
Однако если в основании, содержащем две или более гидроксогруппы, заменить одну группу на кислотный остаток, получается соль. Такую соль относят к основным солям. Например, гидроксохлорид магния MgOHCl, гидроксобромид цинка ZnOHBr.
Основная соль образуется в результате неполного замещения анионов гидроксогруппы в основании на анионы кислотного остатка.
Самая известная основная соль — гидроксокарбонат меди(II) (СuOН)2СO3, или малахит.
Кислотные остатки солей образуют и амфотерные гидроксиды. Наиболее известная соль такого типа — знаменитая благородная шпинель, венчающая корону Российской империи. Химическую основу этого минерала составляет алюминат магния Mg(AlO2)2, или MgAl2O4.
Несолеобразующие или безразличные оксиды (не образуют солей) — СО, NO, N2O.
Названия солей.
Названия солей складываются из двух слов: латинского названия кислотного остатка и русского названия металла в родительном падеже. Формулы читают справа налево.
Название бинарной соли содержит суффикс «-ид»: ZnS — сульфид цинка, ВаСl2 — хлорид бария.
Названия кислородсодержащих солей чаще всего имеют в первом слове суффикс «-ат»: Mn(NO3)2 — нитрат марганца(II), Cr2(SO4)3 — сульфат хрома(III), K2SiO3 — силикат калия.
Названия солей с центральным атомом в промежуточной степени окисления — S +4 , N +3 — содержат суффикс «-ит»: Na2SO3 — сульфит натрия, KNO2 — нитрит калия. Это соли сернистой и азотистой кислот.
Некоторые соли имеют свои традиционные (тривиальные) названия. Так, ряд солей серной кислоты называют купоросами: FeSO4 • 7Н2O — железный купорос, CuSO4 • 5Н2O — медный купорос, ZnSO4 • 7Н2O — цинковый купорос. Общее название нитратов натрия, калия, аммония, кальция и бария — селитры: NaNO3 — натриевая селитра, NH4NO3 — аммонийная селитра. Кроме того, К2СO3 — поташ, AgNO3 — ляпис, РЬСгO4 — желтый крон, Na2SO4 • 10Н2О — глауберова соль, NaCl — поваренная соль, Na2CO3 • 10Н2O — сода кристаллическая, CaSO4 • 2Н2O — гипс.
Общие химические свойства солей
- Соли взаимодействуют с кислотами при соблюдении некоторых условий.
- Соли взаимодействуют со щелочами при соблюдении некоторых условий.
- Растворы солей взаимодействуют с металлами (вспомните электрохимический ряд напряжений металлов и сформулируйте условия протекания таких реакций).
- Соли взаимодействуют с другими солями в растворах при соблюдении ряда условий.
- Соли подвергаются гидролизу (вспомните случаи гидролиза солей).
Всё о соли кратко в одной таблице
Конспект урока по химии «Соли». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Источник статьи: http://uchitel.pro/%D1%81%D0%BE%D0%BB%D0%B8-2/
Соли Классификация состав и названия солей
Соли это твёрдые сложные вещества, которые состоят из катионов металлов, а также анионов кислотных остатков, обладающие самой различной растворимостью в воде.
Солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды.
Основное применение таких веществ как удобрения, химические реагенты и т.д, некоторые из них называются микроэлементами например хлорид натрия NaCl.
Что такое соли
Солями называются электролиты, диссоциирующие в водных растворах с образованием обязательно катиона металла и аниона кислотного остатка.
Классификация солей приведена в табл. 1.
При написании формул любых солей необходимо руководствоваться одним правилом: суммарные заряды катионов и анионов должны быть равны по абсолютной величине.
Исходя из этого, должны расставляться индексы.
Пример написания формулы
На пример, при написании формулы нитрата алюминия мы учитываем ,что заряд катиона алюминия +3, а нитрат-иона — 1: AlNO3(+3), и с помощью индексов уравниваем заряды (наименьшее общее кратное для 3 и 1 равно 3.
Делим 3 на абсолютную величину заряда катиона алюминия — получается индекс. Делим 3 на абсолютную величину заряда аниона NO3 — получается индекс 3). Формула: Al(NO3)3
Классификация солей таблица
| Средние (нормальные) соли | Кислые соли | Основные соли | Двойные соли | Комплексные соли |
| Na2SО4 | NaHCО3 | Сu2(ОН)2СО3 | KAl(SО4)2 | K3[Fe(CN)6] |
| Са3(РО4)2 | Са(Н2РО4)2 | Fe(OH)Cl2 | KNaCO3 | Fe4[Fe(CN)6l3 |
| MgCО3 | KHSО3 | Al(OH)2NО3 | KCr(SО4)2 |
Средние соли это
Средние, или нормальные, соли имеют в своем составе только катионы металла и анионы кислотного остатка.
Их названия образованы от латинского названия элемента, образующего кислотный остаток, путем добавления соответствующего окончания в зависимости от степени окисления этого атома.
Например , соль серной кислоты Na2SО4 носит название сульфат натрия (степень окисления серы +6), соль Na2S — сульфид натрия (степень окисления серы —2) и т. п.
В табл. 2 приведены названия солей, образованных наиболее широко применяемыми кислотами.
Названия средних солей таблица
| Кислота, образующая соль | Название соли |
| HCl | Хлорид |
| HNO3 | Нитрат |
| Н2SO4 | Сульфат |
| Н2SO3 | Сульфит |
| H2S | Сульфид |
| Н3РO4 | Фосфат |
| Н2СО3 | Карбонат |
| H2SiO3 | Силикат |
Названия средних солей лежат в основе всех других групп солей.
Вопросы и ответы для средних солей
106 Напишите формулы следующих средних солей:
Кислые соли
Кислые соли отличаются от средних тем, что в их состав, помимо катиона металла, входит катион водорода, например NaHCO3 или Ca(H2PO4)2.
Кислую соль можно представить как продукт неполного замещения атомов водорода в кислоте металлом. Следовательно, кислые соли могут быть образованы только двух- и более основными кислотами.
В состав молекулы кислой соли обычно входит «кислый» ион, зарядность которого зависит от ступени диссоциации кислоты. Например , диссоциация фосфорной кислоты идет по трем ступеням:
На первой ступени диссоциации образуется однозарядный анион Н2РО4. Следовательно, в зависимости от заряда катиона металла, формулы солей будут выглядеть как NaH2PО4, Са(Н2РО4)2, Ва(Н2РО4)2 и т. д.
На второй ступени диссоциации образуется уже двухзарядный анион HPO 2 4 — . Формулы солей будут иметь такой вид: Na2HPО4, СаНРО4 и т. д. Третья ступень диссоциации кислых солей не дает.
Название кислых солей
Названия кислых солей образованы от названий средних с добавлением приставки гидро-(от слова «гидрогениум» — водород):
- NaHCО3 — гидрокарбонат натрия
- KHSО4 — гидросульфат калия
- СаНРО4 — гидрофосфат кальция
Если в состав кислого иона входят два атома водорода, например Н2РО4 — , то к названию соли добавляется еще приставка ди- (два):
Вопросы ответы для кислые соли
107. Напишите формулы следующих кислых солей:
108. Можно ли получить кислые соли соляной и азотной кислоты. Обоснуйте свой ответ. (См. Ответ)
Основные соли
Основные соли отличаются от остальных тем, что, помимо катиона металла и аниона кислотного остатка, в их состав входят анионы гидроксила, например Al(OH)(NО3)2.
Здесь заряд катиона алюминия +3, а заряды гидроксил-иона—1 и двух нитрат-ионов — 2, всего — 3.
Названия основных солей образованы от названий средних с добавлением слова основной, например : Сu2(ОН)2СO3 — основной карбонат меди, Al(OH)2NO3 — основной нитрат алюминия.
Формулы двойных солей, например KAl(SO4)3, строят, исходя из суммарных зарядов обоих катионов металлов и суммарного заряда анион
Суммарный заряд катионов + 4 , суммарный заряд анионов —4.
Названия двойных солей образуют так же, как и средних, только указывают названия обоих металлов: KAl(SO4)2 — сульфат калия-алюминия.
Ответы вопросы основные соли
109. Напишите формулы следующих основных солей: а) основной хлорид железа (II); б) основной сульфат железа (III); в) основной нитрат меди (II); г) основной хлорид кальция ;д) основной хлорид магния; е) основной сульфат железа (III) ж) основной хлорид алюминия. (См. Ответ)
110. Напишите формулы следующих солей:
а) фосфат магния;
Химические свойства солей
1. Все средние соли являются сильными электролитами и легко диссоциируют:
Средние соли могут взаимодействовать с металлами, стоящими ряду напряжений левее металла, входящего в состав соли:
Fe + Сu 2+ + SO 2 4 — = Сu + Fe 2+ + SO 2 4 —
2. Соли реагируют со щелочами и кислотами по правилам, описанным в разделах «Основания» и «Кислоты»:
Fe 3+ + 3Cl — + 3Na + + 3ОН — = Fe(OH)3 + 3Na + + 3Cl —
2Na + + SO 2 3 — + 2H + + 2Cl — = 2Na + + 2Cl — + SO2 + H2O
3. Соли могут взаимодействовать между собой, в результате чего образуются новые соли:
Ag + + NO3 — + Na + + Cl — = Na + + NO3 — + AgCl
Поскольку эти обменные реакции осуществляются в основном в водных растворах, они протекают лишь тогда, когда одна из образующихся солей выпадает в осадок.
Все реакции обмена идут в соответствии с условиями протекания реакций до конца.
Ответы вопросы химические свойства солей
111. Составьте уравнения следующих реакций и, пользуясь таблицей растворимости, определите, пройдут ли они до конца:
б) хлорид алюминия + нитрат серебра;
в) фосфат натрия + нитрат кальция;
г) хлорид магния + сульфат калия;
е) карбонат калия + сульфат марганца;
ж) нитрат натрия + сульфат калия.
Уравнения записывайте в молекулярной и ионных формах.
112. С какими из перечисленных ниже веществ будет реагировать хлорид железа (II): а) медь; б) карбонат -кальция; в) гидроокись натрия; г) кремниевый ангидрид; д) нитрат серебра; е) гидроокись меди (II); ж) цинк?
Все уравнения записывайте в молекулярной и ионной формах.
113. Опишите свойства карбоната кальция как средней соли. Все уравнения записывайте в молекулярной и ионной формах. (См. Ответ)
114. Как осуществить ряд превращений:
Все уравнения записывайте в молекулярной и ионной формах.
115. Какое количество соли получится при реакции 8 г серы и 18 г цинка?
116. Какой объем водорода выделится при взаимодействии 7 г железа с 20 г серной кислоты?
117. Сколько молей поваренной соли получится при реакции 120 г едкого натра и 120 г соляной кислоты?
118. Сколько нитрата калия получится при реакции 2 молей едкого кали и 130 г азотной кислоты? (См. Ответ)
Гидролиз солей
Специфическим свойством солей является их способность гидролизоваться — подвергаться гидролизу (от греч. «гидро»—вода, «лизис» — разложение), т. е. разложению под действием воды.
Считать гидролиз разложением в том смысле, в каком мы обычно это понимаем, нельзя, но несомненно одно — в реакции гидролиза всегда участвует вода.
Вода — очень слабый электролит, диссоциирует плохо
и не меняет окраску индикатора. Щелочи и кислоты меняют окраску индикаторов, так как при их диссоциации в растворе образуется избыток ионов ОН — (в случае щелочей) и ионов Н + в случае кислот.
В таких солях, как NaCl, K2SО4, которые образованы сильной кислотой (НСl, H2SO4) и сильным основанием (NaOH, КОН), индикаторы окраски не меняют, так как в растворе этих солей гидролиз практически не идет.
При гидролизе солей возможны четыре случая в зависимости от того, сильными или слабыми кислотой и основанием образована соль.
Пример гидролиза солей
1. Если мы возьмем соль сильного основания и слабой кислоты, например K2S, то произойдет следующее. Сульфид калия диссоциирует на ионы как сильный электролит:
Наряду с этим слабо диссоциирует вода:
Анион серы S 2- является анионом слабой сероводородной кислоты, которая диссоциирует плохо. Это приводит к тому, что анион S 2- начинает присоединять к себе из воды катионы водорода, постепенно образуя малодиссоциирующие группировки:
Поскольку катионы Н+ из воды связываются, а анионы ОН — остаются, то реакция среды становится щелочной.
Таким образом, при гидролизе солей, образованных сильным основанием и слабой кислотой, реакция среды всегда бывает щелочная.
2. Если берется соль, образованная слабым основанием и сильной кислотой, например Fe(NО3)3, то при ее диссоциации образуются ионы:
Катион Fe3+ является катионом слабого основания — гидроокиси железа, которая диссоциирует очень плохо.
Это приводит к тому, что катион Fe 3+ начинает присоединять к себе из воды анионы ОН — , образуя при этом мало-диссоциирующие группировки:
Fe(ОH) 2+ + Н + + ОН — = Fe(OH)2 + + Н +
Наконец, процесс может дойти и до последней своей ступени:
Следовательно, в растворе окажется избыток катионов водорода.
Таким образом, при гидролизе соли, образованной слабым основанием и сильной кислотой, реакция среды всегда кислая.
3. Если соль образована сильным основанием и сильной кислотой, то тогда ни катион, ни анион не связывает ионов воды и реакция остается нейтральной. Гидролиз практически не происходит.
4. Если соль образована слабым основанием и слабой кислотой, то реакция среды зависит от их степени диссоциации. Если основание и кислота имеют практически одинаковую степень диссоциации, то реакция среды будет нейтральной.
Вопросы и ответы гидролиза солей
119.Объясните при помощи ионных уравнений процесс гидролиза карбоната натрия. (См. Ответ)
120. Объясните при помощи ионных уравнений ход гидролиза хлорида алюминия. (См. Ответ)
121. Нередко приходится видеть, как при реакции обмена вместо ожидаемого осадка соли выпадает осадок гидроокиси металла, например при реакции между хлоридом железа (III) FeCl3 и карбонатом натрия Na2CО3 образуется не Fe2(CО3)3, a Fe(OH)3. Объясните это явление.
Особенности свойств кислых солей
Несколько иные свойства у кислых солей. Они могут вступать в реакции с сохранением и с разрушением кислого иона.
Например, реакция кислой соли с щелочью приводит к нейтрализации кислой соли и разрушению кислого иона, например :
Na + + HSO4 — + К + + ОН — = К + + Na + + SO 2 4 — + Н2O
Разрушение кислого иона можно представить следующим образом:
Разрушается кислый ион и при реакции с кислотами:
Mg 2+ + 2НСО3 — + 2Н + + 2Сl — = Mg 2+ + 2Сl — + 2Н2O + 2СO2
Нейтрализацию можно проводить той же щелочью, которой образована соль:
Na + + HSO4 — + Na + + ОН — = 2Na + + SO4 2- + H2O
Реакции с солями протекают без разрушения кислого иона:
Са 2+ + 2НСO3 — + 2Na + + СО 2 3 — = CaCO3↓+ 2Na + + 2НСO3 —
Вопросы и ответы особенностей свойств кислых солей
123. Напишите в молекулярной и ионной формах уравнения следующих реакций:
б) гидрофосфат натрия + едкое кали;
в) дигидрофосфат кальция + карбонат натрия;
г) гидрокарбонат бария + сульфат калия;
д) гидросульфит кальция + азотная кислота. (См. Ответ)
Получение солей
На основании изученных свойств основных классов неорганических веществ можно вывести 10 способов получения солей.
1. Взаимодействием металла с неметаллом:
Таким способом могут быть получены только соли бескислородных кислот. Это не ионная реакция.
2. Взаимодействием металла с кислотой:
Fe + 2H + + SO 2 4 — =Fe 2+ + SO 2 4 — + H2↑
3. Взаимодействием металла с солью:
Сu + 2Ag + + 2NO3 — = Cu 2+ 2NO3 — + 2Ag↓
4. Взаимодействием основного окисла с кислотой:
CuO + 2H + + SO 2 4 — = Cu 2+ + SO 2 4 — + H2O
5. Взаимодействием основного окисла с ангидридом кислоты:
6. Взаимодействием кислотного окисла с основанием:
7, Взаимодействие кислот с основанием (нейтрализация):
8. Взаимодействием основания с солью:
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
3Na + + 3ОН — + Fe 3+ + 3Cl — = Fe(OH)3↓ + 3Na — + 3Cl —
9. Взаимодействием кислоты с солью:
2H + + SO 2 4 — + 2Na + + CO 2 3 — =2Na + + SO 2 4 — + H2O + CO2
10. Взаимодействием соли с солью:
Ba 2+ + 2NO3 — + Fe 2+ + SO 2 4 — = Fe 2+ + 2NO3 — + BaSO4↓
Вопросы ответы при получение солей
124. Приведите все известные вам способы получения сульфата бария (все уравнения записывайте в молекулярной и ионной формах).
125. Приведите все возможные общие способы получения хлорида цинка.
126. Смешаны 40 г окиси меди и 200 мл 2 н. раствора серной кислоты. Какое количество сульфата меди при этом образуется?
127. Сколько карбоната кальция получится при реакции 2,8 л СO2 с 200 г 5% раствора Са(ОН)2?
128. Смешаны 300 г 10% раствора серной кислоты и 500 мл 1,5 н. раствора карбоната натрия. Какой объем двуокиси углерода при этом выделится?
129. На 80 г цинка, содержащего 10% примесей, действуют 200 мл 20% соляной кислоты. Сколько хлорида цинка образуется в результате реакции? (См. Ответ)
Что мы узнали о Соли?
Что такое формула солей?
Общая формула солей может быть представлена в виде: Mex(R)y. Mex(R)y ⇄ Mex + + Ry — .
Например : NaCl = Na + + Cl — .
Виды солей в химии?
Кислотные, средние, основные. Если в кислоте все протоны водорода заменены ионами металла, то такие соли называют средними, например , NaCl.
Если водород замещен лишь частично, то такие соли — кислые, например KHSO4 и NaH2PO4. Если гидроксильные группы (OH) – основания замещены кислотным остатком не полностью, то тогда соль — основная, напр. CuCl(OH), Аl(OH)SO4.
Что такое применение солей?
Применение поваренной соли. Сегодня соль — продукт с широким спектром применения. В области медицины соль используют как в производстве медикаментов, так и в домашнем лечении.
Например , горячий соляной компресс отлично справляется с насморком, а концентрированный соляной раствор является природным антисептиком.
С чем реагируют соли?
Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, малодиссоциирующие вещества, например , вода).
Какие соли бывают?
Их виды: купорос и все другие металлические соли, квасцы, бура, винный камень, существенные соли растений, соль винного камня и поташ, летучая мочевая соль, селитра, обыкновенная соль родниковая, морская и каменная, нашатырь, английская соль и другие соли, полученные в результате химических работ.
Статья на тему Соли
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Урок 39. Соли
В уроке 39 «Соли» из курса «Химия для чайников» рассмотрим, что из себя представляют соли, разберём их состав, узнаем, на какие группы они делятся и где встречаются в природе.
Вы уже знаете, что оксиды, кислоты и основания в результате различных реакций образуют соли — наиболее многочисленный класс неорганических веществ.
Состав солей
К солям относятся сложные вещества, в состав которых входят атомы металлов и кислотные остатки.
Общая формула солей — MexАy, где Ме — символ какого-либо металла, А — кислотный остаток. Поскольку разных металлов и кислотных остатков известно много, число образованных ими солей огромно — несколько тысяч. А знакомая нам поваренная соль NaCl — только одно вещество из огромного класса солей. Но не следует думать, что все они соленые на вкус, окрашены в белый цвет и растворимы в воде.
Подавляющее большинство солей обладают совсем другим вкусом. К тому же многие соли ядовиты. Соли могут быть окрашены в разные цвета. Известны соли, которые, в отличие от поваренной, нерастворимы в воде.
Теперь вы не удивитесь тому, что к солям относятся, например, мел, которым вы пишите на доске, или марганцовка из домашней аптечки.
На заметку: Ученые предполагают, что слово «соль» происходит от слова «Солнце». Дело в том, что под воздействием теплых солнечных лучей вода некоторых озер постепенно испаряется, оставляя на дне твердое белое вещество. Оно пришлось по вкусу древним людям и прочно вошло в нашу жизнь под названием «соль». Позже это слово стали использовать во множественном числе для обозначения целого класса однотипных веществ, которые вы сейчас изучаете.
Классификация солей
По способности растворяться в воде все соли делятся на две большие группы — растворимые и нерастворимые соли. Примеры солей каждой из этих групп приведены на следующей схеме.
Соли в природе и в повседневной жизни человека
Соли очень широко распространены в природе. Огромное их количество содержится в гидросфере, т. е. в жидкой оболочке нашей планеты — в воде океанов и морей. Морская вода горькая на вкус. Это объясняется наличием в ней растворенных солей. Особенно много их в воде Мертвого моря. Представьте, что в такой воде объемом 1 л содержатся соли массой от 350 до 420 г! Общая же масса солей, растворенных в воде всех морей и океанов нашей планеты, огромна и равна примерно 5·1019 кг. Около 3/4 этой массы приходится на очень важный для нас хлорид натрия NaCl, а оставшуюся четверть составляют соли калия, кальция, магния, железа и других металлов. Вода океанов и морей содержит соли, в состав которых входят атомы большинства известных химических элементов.
Хлорид натрия и хлорид калия в виде минерала сильвинита (рис. 123) содержатся и в твердой оболочке нашей планеты — в земной коре. В некоторых ее участках, расположенных не очень далеко от поверхности, этих солей особенно много. Такие участки суши называются месторождениями. Одно из крупнейших в мире месторождений сильвинита (Старобинское) находится на территории Беларуси (Солигорский район Минской области).
К важнейшим природным солям относятся также карбонат кальция CaCO3, фосфат кальция Сa3(PO4)2 и сульфат кальция СaSO4. Большие залежи карбоната кальция в виде известняка и минерала кальцита встречаются на поверхности земли, а в виде мела — на дне океанов и морей. Обратите внимание: мел, которым вы пишите на доске, — одна из самых распространенных на Земле солей!
Большое число солей используется нами в повседневной жизни. Самая главная соль, которую мы используем в быту, — поваренная, или кухонная, соль NaCl. Она не только улучшает вкус пищи, но и участвует в важных процессах в организме, поддерживающих нашу жизнь. В сутки организму взрослого человека требуется эта соль массой от 6 до 9 г.
Краткие выводы урока:
- Соли — самый многочисленный класс неорганических соединений.
- По способности растворяться в воде соли делятся на растворимые и нерастворимые.
- Соли находят широкое практическое применение.
Надеюсь урок 39 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник статьи: http://himi4ka.ru/arhiv-urokov/urok-39-soli.html
Химические свойства солей

Всего получено оценок: 984.
Всего получено оценок: 984.
Сложные неорганические соединения, образованные металлами и кислотными остатками, называются солями. Химические свойства солей позволяют получать различные соединения.
где М – металл, Ac – кислотный остаток, n и m – количество атомов металла и кислотного остатка соответственно.
По составу и образованию соли делятся на шесть видов:
- средние(нормальные) – образуются путём полного замещения водорода в кислоте атомами металла или гидроксильной группы в основании кислотными остатками (Na3PO4 образован из H3PO4, CuSO4 – из Cu(OH)2, AlCl3 – из HCl);
- кислые– образуются при неполном замещении водорода в кислотах атомами металла (NaHSO4 образован при присоединении Na к H2SO4, Na2HPO4 – из H3PO4);
- основные– образуются при неполном замещении гидроксильных групп кислотными остатками (CaOHCl образован из Ca(OH)2, FeOHCl2 – из Fe(OH)3);
- двойные– состоят из двух металлов и одного кислотного остатка (КNaSO4);
- смешанные– состоят из одного металла и нескольких кислотных остатков (CaClBr);
- комплексные– состоят из комплексного аниона или катиона ([Cu(NH3)4]SO4).
Наиболее активными являются кислые соли, включающие водород. Химические свойства кислых солей сходны со свойствами кислот. Они взаимодействуют с металлами, их оксидами и гидроксидами, другими солями, щелочами.
Физические свойства
Соли – это кристаллические вещества разных цветов.
Основные физические свойства солей:
- ионная кристаллическая решётка;
- высокие температуры плавления;
- в твёрдом состоянии плохо проводят электричество;
- по растворимости выделяют растворимые, малорастворимые и нерастворимые соли.
Некоторые соли имеют ковалентное или промежуточное, образованное ионными и ковалентными связями, строение.
Получение
Соли образуются из кислот и оснований. Реакции кислоты с различными веществами:
Основания могут взаимодействовать:
Существую также другие способы получения:
-
взаимодействие двух солей –
Химические свойства
Растворимые соли являются электролитами и подвержены реакции диссоциации. При взаимодействии с водой они распадаются, т.е. диссоциируют на положительно и отрицательно заряженные ионы – катионы и анионы соответственно. Катионами являются ионы металлов, анионами – кислотные остатки. Примеры ионных уравнений:
Помимо катионов металлов в солях могут присутствовать катионы аммония (NH4 + ) и фосфония (PH4 + ).
Другие реакции описаны в таблице химических свойств солей.
Особенности
Более активный металл вытесняет менее активный
Свойственно солям, образованным более слабыми кислотами. Образуются новые соли
Взаимодействуют соли, образованные нерастворимыми основаниями
Взаимодействуют растворимые соли. Образуется осадок
Некоторые соли в зависимости от вида разлагаются при нагревании на оксид металла и простые вещества. Например, СаСO3 → СаO + СО2, 2AgCl → Ag + Cl2.
Что мы узнали?
Из урока 8 класса химии узнали об особенностях и видах солей. Сложные неорганические соединения состоят из металлов и кислотных остатков. Могут включать водород (кислые соли), два металла или два кислотных остатка. Это твёрдые кристаллические вещества, которые образуются в результате реакций кислот или щелочей с металлами. Реагируют с основаниями, кислотами, металлами, другими солями.
Источник статьи: http://obrazovaka.ru/himiya/himicheskie-svoystva-soley.html

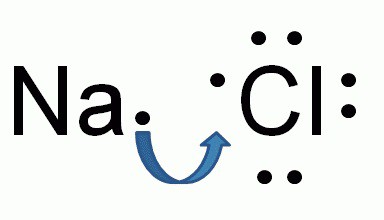

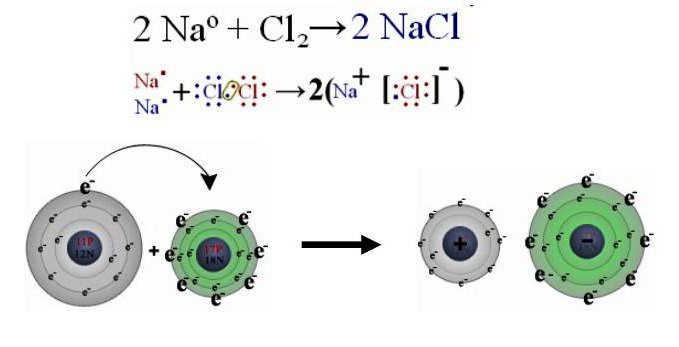














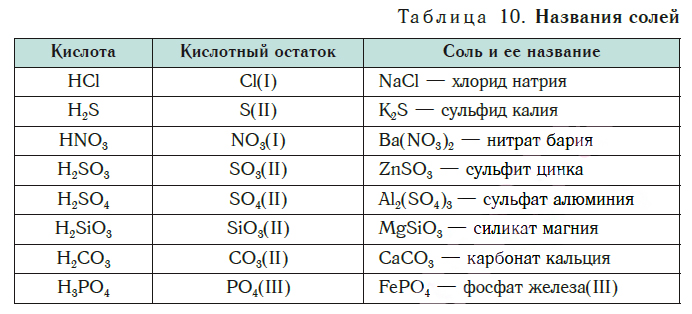
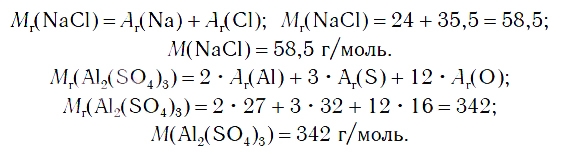
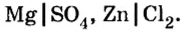

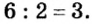
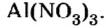
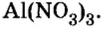
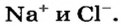
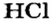
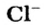
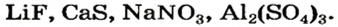
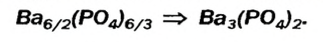
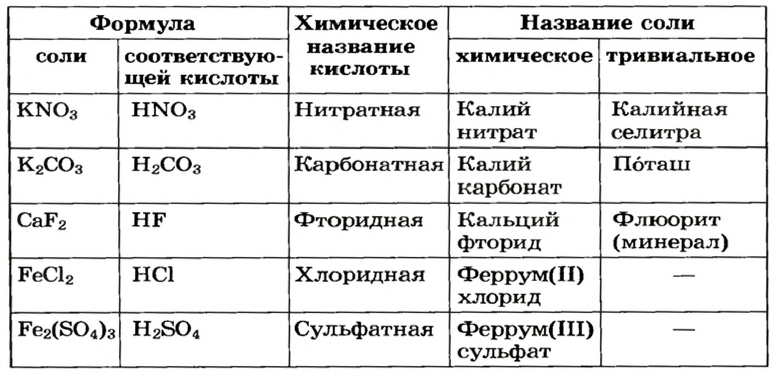

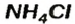 — аммоний хлорид;
— аммоний хлорид;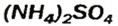 — аммоний сульфат;
— аммоний сульфат;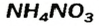 — аммоний нитрат.
— аммоний нитрат.
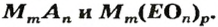
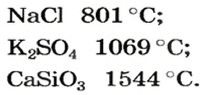


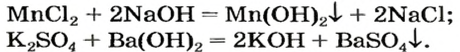
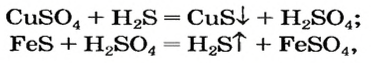
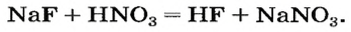


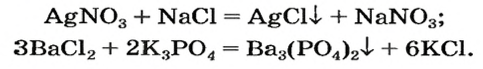
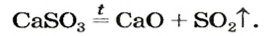
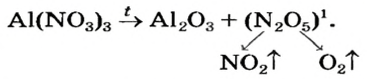
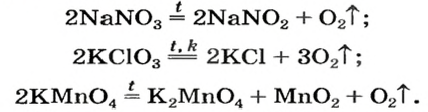

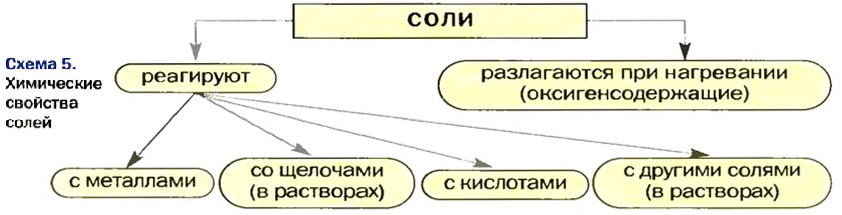
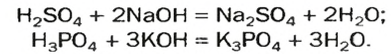
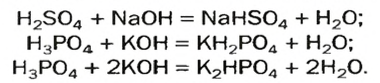
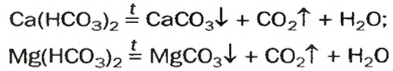

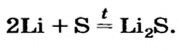
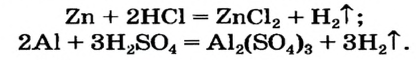
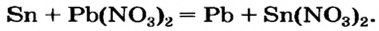
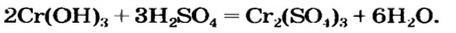
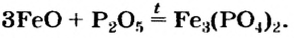
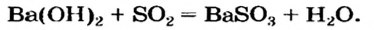
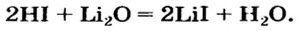
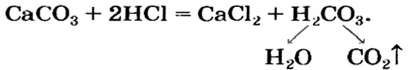
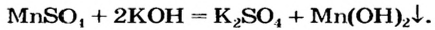
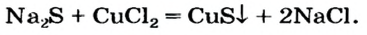

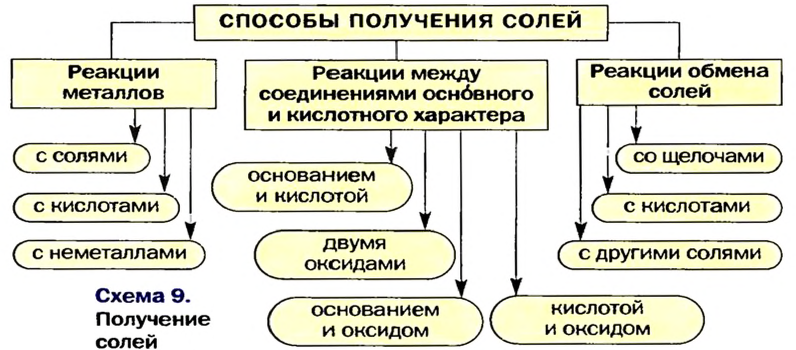

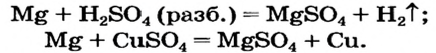
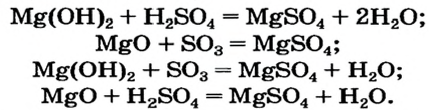
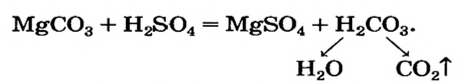
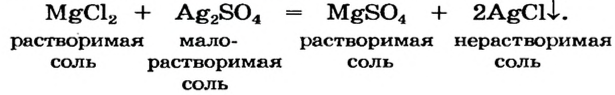
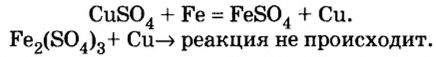
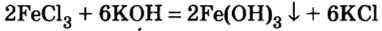
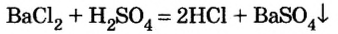
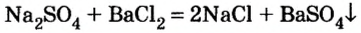
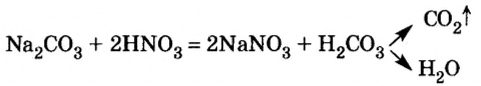
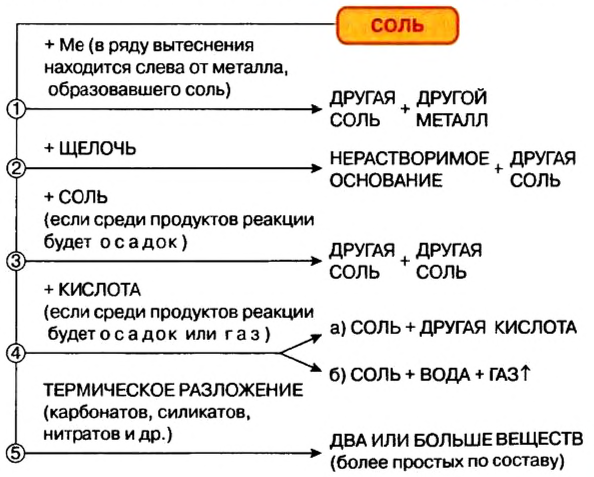
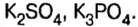
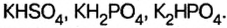
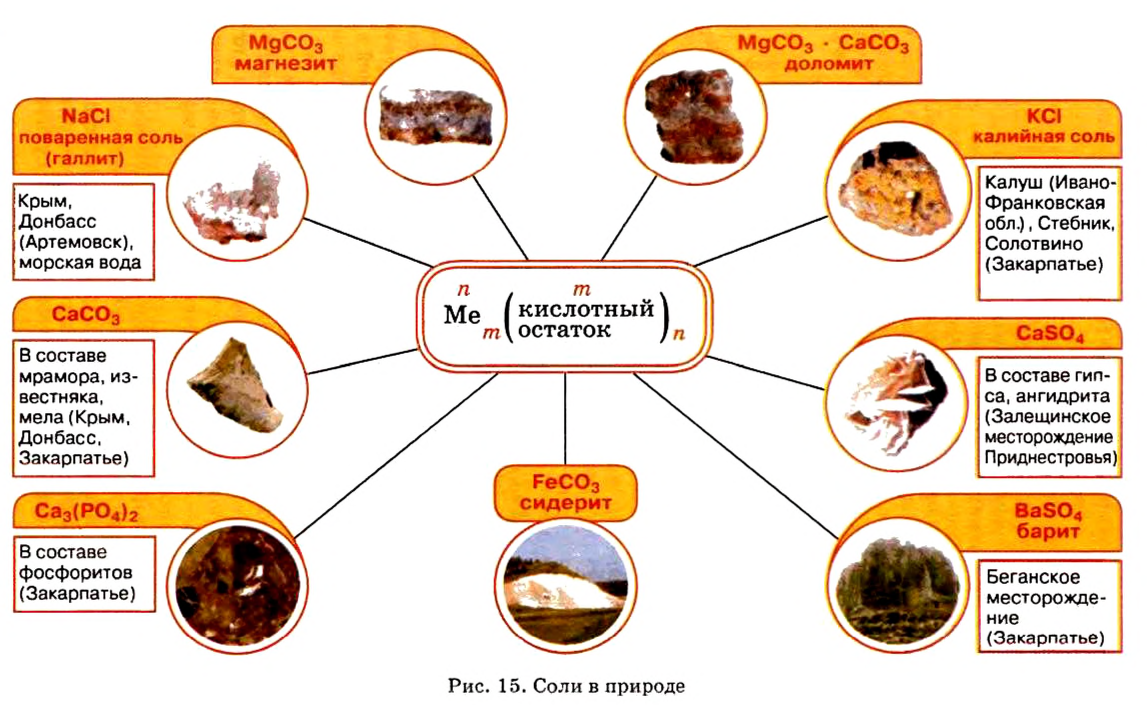
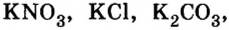
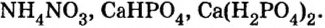

 -калийное удобрение
-калийное удобрение – производство фосфорных удобрений, ортофосфорной кислоты
– производство фосфорных удобрений, ортофосфорной кислоты – в фотографии и серебрении
– в фотографии и серебрении – производство удобрений и взрывчатых веществ; средство для консервирования в пищевой промышленности
– производство удобрений и взрывчатых веществ; средство для консервирования в пищевой промышленности – удобрение; в производстве черного пороха, спичек
– удобрение; в производстве черного пороха, спичек – сырье для получения
– сырье для получения 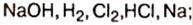 в качестве консервирующего и лекарственного средства; пищевой продукт -поваренная соль
в качестве консервирующего и лекарственного средства; пищевой продукт -поваренная соль – очистка воды; крашение кожи; в проклеивании бумаги
– очистка воды; крашение кожи; в проклеивании бумаги – производство красок; в качестве наполнителя в производстве бумаги и каучука; рентгено-контрастный материал в медицине
– производство красок; в качестве наполнителя в производстве бумаги и каучука; рентгено-контрастный материал в медицине – средство защиты растений; производство ацетатного волокна; в покрытии медью металлических изделий; получение меди высокой чистоты
– средство защиты растений; производство ацетатного волокна; в покрытии медью металлических изделий; получение меди высокой чистоты – сырье для получения других солей
– сырье для получения других солей 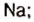 производство стекла, мыла, синтетических моющих средств, эмалей;средство для устранения жесткости воды.
производство стекла, мыла, синтетических моющих средств, эмалей;средство для устранения жесткости воды. – строительный материал; для изготовления оттисков форм, статуэток и др.; для наложения повязок при переломах
– строительный материал; для изготовления оттисков форм, статуэток и др.; для наложения повязок при переломах – разрыхлитель теста; в производстве фотографических проявителей
– разрыхлитель теста; в производстве фотографических проявителей – фосфорное удобрение
– фосфорное удобрение